Ligne directrice sur l’admissibilité (LDA)
Date de révision : 22 janvier 2025
Date de création : février 2005
Code CIM-11 : 9C61
Code médical d'ACC : 00640 glaucome
Cette publication est disponible dans d'autres formats sur demande.
Document complet – Version PDF
Définition
Le glaucome est une atrophie chronique et progressive du nerf optique observée à l’examen de la papille optique, à l’occasion de l’examen du fond de l’œil. En général, la perte de vision qui en résulte est constatée en raison d’une évolution des résultats aux tests du champ visuel. Les changements se produisent habituellement en présence d’une augmentation de la pression intraoculaire (PIO).
Il existe deux principaux types de glaucome :
- Le glaucome à angle ouvert survient lorsque la pression augmente dans l’œil en raison de l’évacuation insuffisante de l’humeur aqueuse. La pression accrue causée par l’accumulation de l’humeur aqueuse peut causer une atteinte du nerf optique. Le glaucome à angle ouvert est le type de glaucome le plus comm
- Le glaucome à angle fermé survient lorsque l’iris se retrouve trop près de l’angle irido-cornéen, bloquant le drainage de l’humeur aqueuse et augmentant la pression intraoculaire.
Remarque :
-
Les opticiens peuvent poser un diagnostic de cas suspect de glaucome lorsqu’ils constatent les éléments suivants :
- une papille optique et un champ visuel normaux, associés à une PIO élevée
- une papille optique et/ou un champ visuel suspects, mais une PIO normale
- un angle irido-cornéen anormal
- d’importants antécédents familiaux de glaucome sévère.
La présente ligne directrice sur l’admissibilité (LDA) n’inclut pas le diagnostic de cas suspect de glaucome.
- Dans les cas où un opticien pose un diagnostic de glaucome fondé sur les constatations suivantes, Anciens Combattants Canada (ACC) accepte le diagnostic de glaucome aux fins de l’admissibilité et de l’évaluation :
- une PIO élevée, mais ni évolution des résultats d’examen du fond de l’œil ni perte d’acuité visuelle
- des lacunes du champ visuel inexpliquées compatibles avec un glaucome, mais ni évolution des résultats d’examen du fond de l’œil ni PIO élevée
- une évolution caractéristique des résultats d’examen du fond de l’œil, mais ni PIO élevée ni lacunes du champ visuel.
- Le glaucome est considéré comme une affection bilatérale, sauf s’il est associé à un traumatisme, à une intervention chirurgicale ou à une hémorragie intraorbitaire ayant touché l’œil concerné.
Norme diagnostique
Le diagnostic d’un ophtalmologiste autorisé est requis.
Un examen de l’acuité visuelle et du champ visuel (périmétrie) ainsi que la mesure de la pression intraoculaire (tonométrie) doivent avoir été effectués. Les rapports doivent accompagner la demande.
Anatomie et physiologie
L’œil est formé de trois chambres : la chambre antérieure, devant l’iris, la chambre postérieure, entre l’iris et le cristallin, et l’espace compris entre la rétine et la face postérieure du cristallin (Figure 1 : Anatomie de l’oeil).
Le maintien de la PIO résulte d’un équilibre entre la sécrétion et l’excrétion de l’humeur aqueuse, le liquide qui occupe les chambres antérieure et postérieure de l’œil et qui en irrigue les structures transparentes. L’humeur aqueuse est sécrétée par le corps ciliaire, une glande qui se trouve derrière l’iris. L’humeur aqueuse traverse la pupille pour arriver dans la chambre antérieure de l’œil dont elle gagne la périphérie pour atteindre l’angle irido-cornéen. Là, elle s’infiltre à travers le trabéculum cornéo-scléral, emprunte le canal de Schlemm, puis gagne la circulation veineuse.
L’espace compris entre le cristallin et la rétine contient une masse gélatineuse, l’humeur vitrée (ou « le vitré »). L’augmentation de la PIO dans la chambre antérieure se transmet à la rétine et au nerf optique par le vitré.
Figure 1 : Anatomie de l’œil
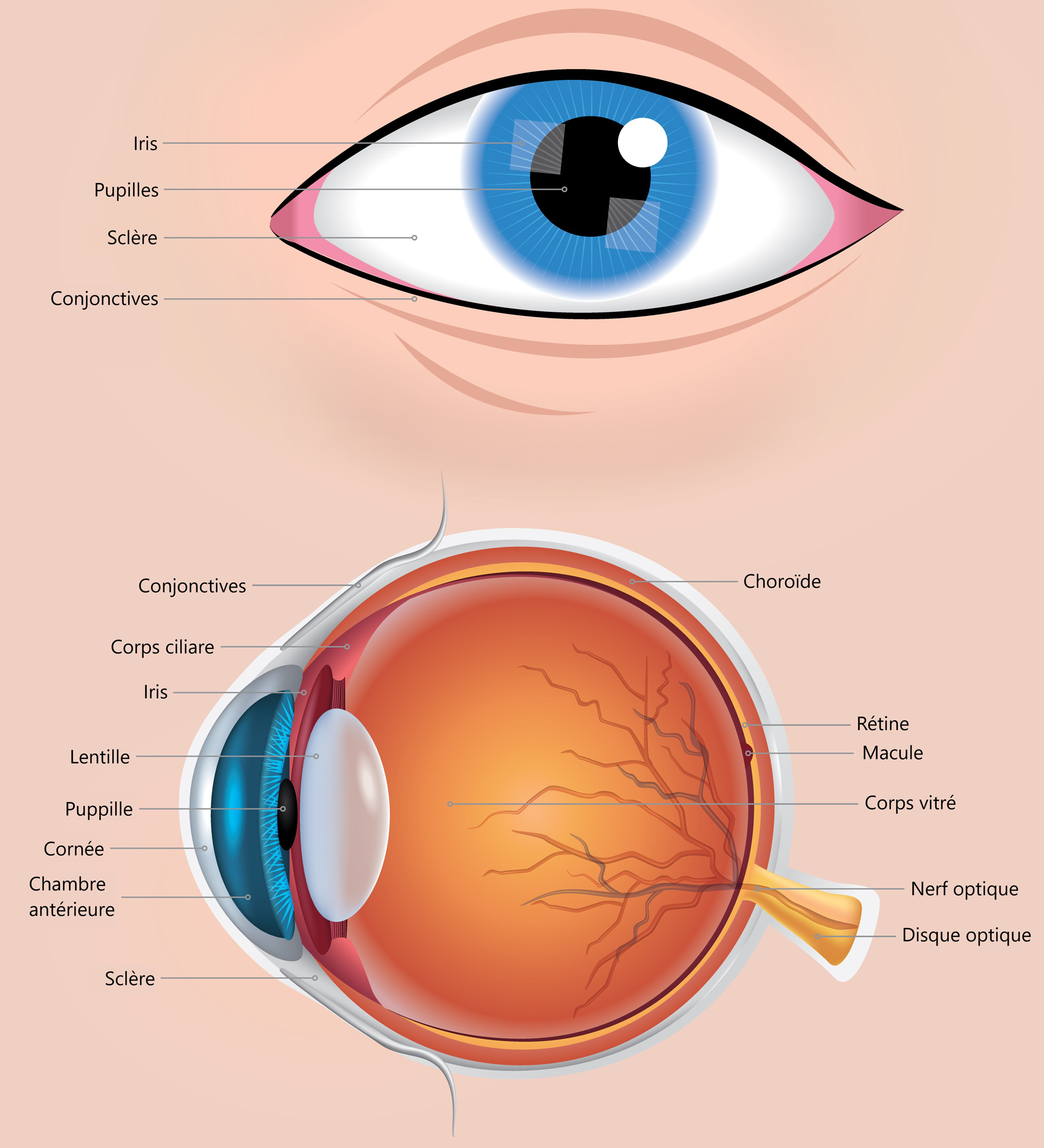
Image du haut : une vue avant de l’œil, mettant en avant l’iris, la pupille, la sclère et la conjonctive. Image du bas : une vue en coupe transversale montrant ces mêmes sections, ainsi que des structures internes supplémentaires. Les corps ciliaires, la lentille, la cornée et la chambre antérieure. L’arrière de l’œil comprend la choroïde, la rétine, la macula, le corps vitré, le nerf optique et le disque optique. Source : Anciens Combattants Canada (2024).
Un certain nombre de systèmes de classification du glaucome ont été proposés. Ils se fondent sur la catégorie d’âge de la personne (enfance, jeunesse, âge adulte), le site d’obstruction de l’évacuation aqueuse (obstacle prétrabéculaire, trabéculaire, post-trabéculaire), le tissu principalement atteint (un glaucome peut par exemple être causé par des atteintes du cristallin) et l’étiologie. Bien que chacun de ces systèmes soit valable, le système de classification qui répartit les cas entre glaucome à angle fermé et glaucome à angle ouvert est le plus largement utilisé; il est axé sur les aspects physiopathologiques et oriente la prise en charge clinique.
Voici un aperçu de la classification des cas, répartis entre glaucome à angle ouvert, glaucome à angle fermé, glaucome mixte et glaucome infantile :
Le glaucome à angle ouvert survient lorsque la pression augmente dans l’œil en raison de l’évacuation insuffisante de l’humeur aqueuse. La pression accrue causée par l’accumulation de l’humeur aqueuse peut causer une atteinte du nerf optique. Le glaucome à angle ouvert est le type de glaucome le plus commun.
Le glaucome à angle fermé survient lorsque l’iris se retrouve trop près de l’angle irido-cornéen, bloquant le drainage de l’humeur aqueuse et augmentant la pression intraoculaire. La pression accrue causée par l’accumulation de l’humeur aqueuse peut causer une atteinte du nerf optique. L’augmentation de la pression se produit généralement au fil du temps et est asymptomatique. En cas de fermeture aiguë de l’angle, l’augmentation de la pression peut également se produire de façon aiguë, surtout lorsqu’elle est consécutive à la prise d’un médicament, et peut entraîner de la douleur et une perte visuelle. Un glaucome aigu à angle fermé peut causer la cécité s’il n’est pas traité rapidement.
- Le glaucome à angle ouvert peut prendre les formes suivantes :
- Un glaucome primitif à angle ouvert avec :
- une atteinte du nerf optique et une altération du champ visuel, associées à une augmentation de la PIO
- une obstruction du trabéculum de cause inconnue.
- Un glaucome sans hypertension oculaire (PIO normale), avec atteinte du nerf optique et altération du champ visuel.
- Un glaucome secondaire à angle ouvert avec :
- une résistance accrue à l’écoulement à travers le trabéculum cornéo-scléral associée à une autre affection, comme le glaucome pigmentaire, le glaucome phacolytique, le glaucome induit par les stéroïdes, l’ophtalmie et le glaucome à cellules fantômes
- une résistance post-trabéculaire accrue, consécutive à une pression veineuse épisclérale élevée, par exemple en cas de fistule carotido-caverneuse.
- Un glaucome primitif à angle ouvert avec :
- Le glaucome à angle fermé peut prendre les formes suivantes :
- Un glaucome primitif à angle fermé avec bloc pupillaire relatif où le débit de l’humeur aqueuse de la chambre postérieure à la chambre antérieure est réduit et où la périphérie de l’iris est en contact avec le trabéculum cornéo-scléral.
- Un glaucome primitif à angle fermé sans bloc pupillaire, par exemple en cas de syndrome d’iris plateau.
- Un glaucome secondaire à angle fermé avec bloc pupillaire, par exemple en cas d’épaississement du cristallin ou de semi-mydriase de la pupille.
- Un glaucome secondaire à angle fermé sans bloc pupillaire.
- Un mécanisme de poussée postérieure qui fait avancer le diaphragme irido-cristallinien, par exemple en cas de tumeur du segment postérieur, d’opération de plissement scléral ou d’effusion uvéale.
- Un mécanisme rétractant le prolongement du segment antérieur de l’iris et formant des synéchies antérieures périphériques, par exemple en cas de syndrome irido-cornéo-endothélial, de glaucome néovasculaire ou d’inflammation.
- Le glaucome mixte est une combinaison de deux formes ou plus de glaucome, par exemple dans le cas où une personne atteinte de glaucome à angle ouvert développe un glaucome à angle fermé secondaire à une opération de plissement scléral.
- Le glaucome infantile peut prendre les formes suivantes :
- un glaucome primitif congénital/infantile
- un glaucome juvénile
- un glaucome associé à des anomalies congénitales :
- des troubles oculaires, par exemple la dysgénésie du segment antérieur ou l’aniridie
- des troubles généraux, comme la rubéole ou le syndrome oculo-cérébro-rénal de Lowe.
- un glaucome secondaire chez les bébés et les enfants, par exemple le glaucome consécutif à un rétinoblastome ou à un traumatisme.
Caractéristiques cliniques
Le glaucome est l’une des principales causes de cécité. Le glaucome apparaît habituellement en présence d’une forte prédisposition familiale.
Une PIO de 21 mmHg ou plus est associée au glaucome. Cette hypertension peut atteindre le nerf optique, dont la tête est appelée « papille optique ». L’excavation de la papille optique peut survenir, et celle-ci peut prendre un aspect blanchâtre; il en résulte des « taches aveugles » ou des scotomes dans le champ visuel de la personne. Ces scotomes peuvent s’étendre, se fondre les uns dans les autres et, finalement, mener à la cécité.
Une PIO de 21 mmHg ou plus ne se traduit pas nécessairement par un diagnostic de glaucome, car la personne doit également présenter une altération glaucomateuse du champ visuel ou une atteinte du nerf optique. Il y a des personnes chez qui la PIO est supérieure à 21 qui ne développent jamais de glaucome, ainsi que des personnes aux yeux sensibles qui développent des altérations glaucomateuses du champ visuel alors que leur PIO est inférieure à 21.
Bien que le champ visuel périphérique rétrécisse graduellement, la capacité de fixer et de suivre une cible demeure inchangée jusqu’aux derniers stades de la maladie.
Le glaucome à angle ouvert est asymptomatique à ses premiers stades, mais peut entraîner la cécité s’il n’est pas traité. Il ne cause habituellement pas de douleur ni de rougeur oculaire, et la pression intraoculaire n’est que modérément élevée en sa présence. C’est une affection bilatérale, d’installation insidieuse qui évolue lentement. Lorsque la personne se rend compte d’une perte de vision, l’atteinte irréversible de sa vision périphérique est considérable.
Le glaucome à angle fermé survient lorsque l’iris se retrouve trop près de l’angle irido-cornéen, bloquant le drainage de l’humeur aqueuse et augmentant la pression intraoculaire. La pression accrue causée par l’accumulation de l’humeur aqueuse peut causer une atteinte du nerf optique. L’augmentation de la pression se produit généralement au fil du temps et est asymptomatique. En cas de fermeture aiguë de l’angle, l’augmentation de la pression peut également se produire de façon aiguë, surtout lorsqu’elle est consécutive à la prise d’un médicament, et peut entraîner de la douleur et une perte visuelle. Un glaucome aigu à angle fermé peut causer la cécité s’il n’est pas traité rapidement.
Le glaucome congénital est dû à une malformation congénitale de l’angle irido cornéen. La plupart des cas de ce type sont diagnostiqués au cours des trois premiers mois de la vie.
La prévalence du glaucome à angle ouvert est légèrement plus élevée chez les personnes de sexe masculin que chez les personnes de sexe féminin.
La prévalence du glaucome à angle fermé est plus élevée chez les personnes de sexe féminin que chez les personnes de sexe masculin.
Considérations liées à l’admissibilité
Dans la présente section
Section A : Causes et/ou aggravation
Aux fins de l’admissibilité à ACC, on considère que les facteurs suivants causent ou aggravent les conditions énumérées dans la section des définitions de la présente LDA, et peuvent être pris en considération avec les éléments de preuve pour aider à établir un lien avec le service. Les facteurs énumérés dans la section A ont été déterminés sur la base d’une analyse de la littérature scientifique et médicale actualisée, ainsi que des meilleures pratiques médicales fondées sur des données probantes. Des facteurs autres que ceux énumérés à la section A peuvent être pris en considération, mais il est recommandé de consulter un consultant en prestations d’invalidité ou un conseiller médical.
Les conditions énoncées ci-dessous sont fournies à titre indicatif. Dans chaque cas, la décision doit être prise en fonction du bien-fondé de la demande et des éléments de preuve fournis.
Facteurs
Remarque : Sauf indication contraire, les facteurs suivants peuvent être associés au glaucome à angle fermé et au glaucome à angle ouvert.
- La cause peut être de nature inconnue ou idiopathique.
- Avoir eu une uvéite ou une sclérite dans les trois mois avant l’apparition clinique ou l’aggravation du glaucome. L’uvéite est une inflammation de la tunique moyenne, ou tunique vasculaire du bulbe, composée de l’iris, du corps ciliaire et de la choroïde. La sclérite est une inflammation de la sclère, la couche fibreuse externe de l'œil (le blanc de l'œil). La sclère suit le tissu conjonctif de la cornée.
- Avoir subi un traumatisme important à l’œil touché, au cours des quelques mois avant l’apparition clinique ou l’aggravation du glaucome. Par « traumatisme important », on entend une lésion pénétrante, un traumatisme contondant, des radiolésions ou des brûlures par un acide à l’œil atteint, ayant entraîné une inflammation intraoculaire, un saignement ou d’autres lésions tissulaires.
- Avoir subi une greffe de la cornée (kératoplastie) ou une autre chirurgie intraoculaire de l’œil touché à n’importe quel moment avant l’apparition clinique ou l’aggravation du glaucome.
La kératoplastie est une intervention chirurgicale au cours de laquelle toute l’épaisseur de la cornée est remplacée par des tissus de donneur.
Remarque : Les chirurgies non compliquées d’une partie de la cornée, comme celles qui sont effectuées en cas d’erreurs de réfraction, dont la kératectomie photoréfractive (KPR) et le kératomileusis in situ assisté par laser (LASIK), ne sont pas considérées comme causant le glaucome.
- Avoir eu une pseudoexfoliation dans l’œil touché avant l’apparition clinique ou l’aggravation du glaucome. Lorsqu’il y a pseudoexfoliation, on peut observer des dépôts protéiques floconneux sur la capsule cristallinienne, la face postérieure de l’iris, les procès ciliaires et la zonule, dans le trabéculum cornéo-scléral et flottant dans la chambre antérieure. Cette substance se dépose dans le trabéculum cornéo-scléral et bloque l’écoulement de l’humeur aqueuse, ce qui entraîne une augmentation de la PIO.
- Souffrir dans l’œil touché du syndrome irido-cornéo-endothélial (ICE) au moment de l’apparition clinique ou de l’aggravation du glaucome. Il existe trois sous-types de syndrome ICE : le syndrome de Chandler, le syndrome de Cogan et l’atrophie essentielle de l’iris.
- S’être vu injecter de l’huile de silicone dans l’œil touché avant clinique ou l’aggravation du glaucome. Il arrive que l’on injecte de l’huile de silicone dans un œil afin de remédier au décollement de la rétine.
- Incapacité d’obtenir un traitement médical approprié du glaucome.
Facteurs associés au glaucome à angle fermé seulement :
- Avoir une cataracte dans l’œil atteint au moment de l’apparition clinique ou de l’aggravation du glaucome à angle fermé.
- Avoir une subluxation ou une luxation antérieure du cristallin de l’œil atteint au moment de l’apparition clinique ou de l’aggravation du glaucome à angle fermé.
- Avoir pris des médicaments juste avant l’apparition clinique ou de l’aggravation du glaucome à angle fermé. De multiples mécanismes médicamenteux peuvent causer le glaucome; nombre des médicaments susceptibles de causer le glaucome ne le causent en réalité qu’assez peu fréquemment. C’est l’ophtalmologiste traitant qui est le plus à même de relever les causes médicamenteuses du glaucome.
S’il est déclaré qu’un médicament a causé l’apparition clinique ou l’aggravation du glaucome à angle fermé, il faut établir les faits suivants :
- L’ophtalmologiste traitant a indiqué que le médicament est la cause de l’apparition ou de l’aggravation du glaucome à angle fermé.
- Le médicament a été prescrit pour traiter une affection admissible.
- La personne prenait le médicament au moment de l’apparition clinique ou de l’aggravation du glaucome à angle fermé.
Remarque : En ce qui concerne les corticostéroïdes, veuillez voir le facteur no 12 ci-dessous.
Facteurs associés au glaucome à angle ouvert seulement :
- Prendre des corticostéroïdes, uniquement par les voies suivantes, au moment de l’apparition clinique ou de l’aggravation du glaucome secondaire à angle ouvert :
- traitement à long terme par corticostéroïdes en aérosol inhalés (les inhalateurs multidoses sont exclus)
- application topique à long terme de corticostéroïdes très puissants près de l’œil
- application topique dans l’œil (gouttes ou onguent ophtalmique)
- injection intravitréenne (dans l’œil)
- administration par voie générale à long terme.
En augmentant la résistance à l’écoulement de l’humeur aqueuse à travers le trabéculum cornéo-scléral, les stéroïdes peuvent augmenter la PIO.
- Avoir un hématome intraorbitaire au moment de l’apparition clinique ou de l’aggravation du glaucome secondaire à angle ouvert ou en avoir eu un juste avant. La dégradation des érythrocytes et la fuite de l’hémoglobine hors de celles-ci (cellules fantômes) peuvent obstruer l’écoulement de l’humeur aqueuse et causer le glaucome à cellules fantômes. Parmi les hématomes intraorbitaires, il y a entre autres :
- l’hémorragie du corps vitré
- l’hyphéma et le microhyphéma
- le fait d’avoir eu une chirurgie intraoculaire à l’œil touché avant l’apparition clinique de l’hématome intraorbitaire.
- Présenter une fuite de protéines cristalliniennes au moment de l’apparition clinique ou de l’aggravation du glaucome secondaire à angle ouvert ou avoir présenté une telle situation juste avant. Les protéines peuvent obstruer le trabéculum cornéo-scléral et réduire l’écoulement de l’humeur aqueuse, ce qui cause un glaucome induit par le cristallin. Parmi les glaucomes induits par le cristallin, il y a :
- Le glaucome phacolytique, qui est secondaire à l’évolution d’une cataracte mûre et à la libération de protéines cristalliniennes dans l’humeur aqueuse.
- Le glaucome lié aux particules cristalliniennes, qui résulte de la fuite de protéines cristalliniennes dans l’humeur aqueuse associée à une rupture de la capsule du cristallin. Un tel glaucome peut en effet survenir à la suite d’une rupture capsulaire, par exemple en cas de lésions au cristallin, de chirurgie de la cataracte ou de capsulotomie au laser.
- Le glaucome phacoantigénique, qui résulte d’une réaction inflammatoire contre les protéines oculaires libérées par la rupture du cristallin, par exemple en cas de lésions au cristallin, de chirurgie de la cataracte ou de capsulotomie au laser.
- Présenter un syndrome de dispersion pigmentaire (SDP) au moment de l’apparition clinique ou de l’aggravation du glaucome secondaire à angle ouvert. Le SDP entraîne la libération de pigments de l’épithélium de l’iris. Les pigments peuvent obstruer le trabéculum cornéo-scléral et réduire l’écoulement de l’humeur aqueuse.
- Avoir une pression veineuse épisclérale élevée et, par conséquent, une pression trabéculaire élevée au moment de l’apparition clinique ou de l’aggravation du glaucome secondaire à angle ouvert. Parmi les causes, il y a :
- l’obstruction veineuse (p. ex. l’obstruction de la veine cave supérieure ou une tumeur derrière l’œil)
- les anomalies artérioveineuses (p. ex. une fistule carotido-caverneuse).
- Présenter une néovascularisation dans l’angle irido-cornéen de l’œil touché au moment de l’apparition clinique ou de l’aggravation du glaucome secondaire à angle ouvert. La néovascularisation consiste en la formation de nouveaux vaisseaux sanguins. Parmi les affections qui peuvent causer la néovascularisation, il y a :
- l’occlusion veineuse rétinienne centrale de l’œil atteint
- une rétinopathie diabétique proliférante dans l’œil atteint
- une sténose athéromateuse de la carotide homolatérale touchant l’œil atteint
- un décollement de la rétine dans l’œil atteint
- une radiothérapie dans la région de l’œil atteint.
Section B : Affections dont il faut tenir compte dans la détermination de l’admissibilité/l’évaluation
La section B fournit une liste des affections diagnostiquées qu’ACC prend en considération dans la détermination de l’admissibilité et l’évaluation du glaucome. Aucune affection médicale comprise n’a été relevée au moment de la publication de la présente LDA.
Section C : Affections courantes pouvant découler en totalité ou en partie du glaucome et/ou de son traitement
Aucune affection médicale consécutive n’a été relevée au moment de la publication de la présente LDA. Si le bien-fondé du cas et les preuves médicales indiquent qu’il peut exister une relation corrélative, il est recommandé de consulter un consultant en prestations d’invalidité ou un conseiller médical.
Liens
Directives et politiques connexes d’ACC :
- Indemnité pour douleur et souffrance – Politiques
- Demandes de pension d'invalidité de la Gendarmerie royale canadienne – Politiques
- Admissibilité double – Prestations d’invalidité – Politiques
- Détermination d’une invalidité – Politiques
- Prestations d’invalidité versées à l’égard du service en temps de paix – Principe d’indemnisation – Politiques
- Prestations d’invalidité versées à l’égard du service en temps de guerre et du service spécial – Principe d’assurance – Politiques
- Invalidité consécutive à une blessure ou maladie non liée au service – Politiques
- Invalidité consécutive – Politiques
- Bénéfice du doute – Politiques
Références compter à 22 janvier 2025
Disponible en anglais seulement
Albert, D.M., & Jakobiec, F.A. (2000). Principles and Practices of Ophthalmology. W.B Saunders Company.
Alvarez-Guzman, C., Hartleben-Matkin, C., Ruiz-Lozano, R. E., Rodriguez-Garcia, A., Quiroga-Garza, M. E., & Valdez-Garcia, J. E. (2022). Risk factors for secondary Glaucoma in patients with Vogt-Koyanagi-Harada disease. Journal of Ophthalmic Inflammation and Infection, 12(1), 22. https://doi.org/10.1186/s12348-022-00300-7
Alvarez-Guzman, C., Valdez-Garcia, J. E., Ruiz-Lozano, R. E., Rodriguez-Garcia, A., Navas-Villar, C. F., Hartleben-Matkin, C., & Pedroza-Seres, M. (2022). High prevalence of angle-closure glaucoma in Vogt-Koyanagi-Harada disease. International Ophthalmology, 42(12), 3913–3921. https://doi.org/10.1007/s10792-022-02412-4
American Academy of Ophthalmology. What Is Glaucoma? Symptoms, Causes, Diagnosis, Treatment. (2023).
American Academy of Ophthalmology. (1989). Glaucoma, Lens and Anterior Segment Trauma. In Basic and Clinical Science Course 1994-1995. Continuing Education in Ophthalmology.
American Society of Health-System Pharmacists. (2023). Topiramate. https://medlineplus.gov/druginfo/meds/a697012.html
Australian Government Repatriation Medical Authority. (1995) Statement of Principles concerning angle-closure glaucoma (Balance of Probabilities) (No 244 of 1995). SOPs - Repatriation Medical Authority
Australian Government Repatriation Medical Authority. (1995) Statement of Principles concerning angle-closure glaucoma (Reasonable Hypothesis) (No 243 of 1995). SOPs - Repatriation Medical Authority
Australian Government Repatriation Medical Authority. (1999) Statement of Principles concerning open-angle glaucoma (Balance of Probabilities) (No 14 of 1999). SOPs - Repatriation Medical Authority
Australian Government Repatriation Medical Authority. (1999). Statement of Principles concerning open-angle glaucoma (Reasonable Hypothesis) (No 13 of 1999). SOPs - Repatriation Medical Authority
Australian Government Repatriation Medical Authority. (2021) Statement of Principles concerning angle-closure glaucoma (Balance of Probabilities) (No. 6 of 2021). SOPs - Repatriation Medical Authority
Australian Government Repatriation Medical Authority. (2021)Statement of Principles concerning angle-closure glaucoma (Reasonable Hypothesis) (No. 5 of 2021). SOPs - Repatriation Medical Authority
Australian Government Repatriation Medical Authority. (2021) Statement of Principles concerning open angle glaucoma (Balance of Probabilities) (No. 50 of 2021). SOPs - Repatriation Medical Authority
Australian Government Repatriation Medical Authority. (2021) Statement of Principles concerning open angle glaucoma (Reasonable Hypothesis) (No. 49 of 2021). SOPs - Repatriation Medical Authority
American Society of Health-System Pharmacists. (2023). Topiramate. https://medlineplus.gov/druginfo/meds/a697012.html
Basoglu, O. K., Emre, S., Bacakoglu, F., & Ates, H. (2001). Glaucoma associated with metered-dose bronchodilator therapy. Respiratory Medicine, 95(10), 844–845. https://doi.org/10.1053/rmed.2001.1164
Berchuck, S., Jammal, A., Mukherjee, S., Somers, T., & Medeiros, F. A. (2021). Impact of anxiety and depression on progression to glaucoma among glaucoma suspects. British Journal of Ophthalmology, 105(9), 1244–1249.
Chen, H.-Y., Lin, C.-L., Lai, S.-W., & Kao, C.-H. (2016). Association of Selective Serotonin Reuptake Inhibitor Use and Acute Angle–Closure Glaucoma. The Journal of Clinical Psychiatry, 77(06), e692–e696. https://doi.org/10.4088/JCP.15m10038
Choi, J., & Kook, M. S. (2015). Systemic and Ocular Hemodynamic Risk Factors in Glaucoma. BioMed Research International, 2015, 1–9. https://doi.org/10.1155/2015/141905
Coleman, A. L., & Miglior, S. (2008). Risk Factors for Glaucoma Onset and Progression. Survey of Ophthalmology, 53(6), S3–S10. https://doi.org/10.1016/j.survophthal.2008.08.006
Dahrouj, M. (2023). Retinal detachment. UpToDate, Inc.
Daniel, B. S., & Orchard, D. (2015). Ocular side–effects of topical corticosteroids: What a dermatologist needs to know. Australasian Journal of Dermatology, 56(3), 164–169. https://doi.org/10.1111/ajd.12292
Delavar, A., Bu, J. J., Radha Saseendrakumar, B., Weinreb, R. N., & Baxter, S. L. (2023). Gender Disparities in Depression, Stress, and Social Support Among Glaucoma Patients. Translational Vision Science & Technology, 12(12), 23. https://doi.org/10.1167/tvst.12.12.23
Douglass, A., Dattilo, M., & Feola, A. J. (2023). Evidence for Menopause as a Sex-Specific Risk Factor for Glaucoma. Cellular and Molecular Neurobiology, 43(1), 79–97. https://doi.org/10.1007/s10571-021-01179-z
Faridi, O., Park, S. C., Liebmann, J. M., & Ritch, R. (2012). Glaucoma and obstructive sleep apnoea syndrome. 40(4), 408–419. https://doi.org/10.1111/j.1442-9071.2012.02768.x
Fotesko, K., Thomsen, B. S. V., Kolko, M., & Vohra, R. (2022). Girl Power in Glaucoma: The Role of Estrogen in Primary Open Angle Glaucoma. Cellular and Molecular Neurobiology, 42(1), 41–57. https://doi.org/10.1007/s10571-020-00965-5
Gedde, S. J., Vinod, K., Wright, M. M., Muir, K. W., Lind, J. T., Chen, P. P., Li, T., & Mansberger, S. L. (2021). Primary Open-Angle Glaucoma Preferred Practice Pattern®. Ophthalmology, 128(1), P71–P150. https://doi.org/10.1016/j.ophtha.2020.10.022
Geller, D. E. (2007). Clinical Side Effects during Aerosol Therapy: Cutaneous and Ocular Effects. Journal of Aerosol Medicine, 20(s1), S100–S109. https://doi.org/10.1089/jam.2007.0585
Groff, M. L., Choi, B., Lin, T., Mcllraith, I., Hutnik, C., & Malvankar-Mehta, M. S. (2023). Anxiety, depression, and sleep-related outcomes of glaucoma patients: Systematic review and meta-analysis. Canadian Journal of Ophthalmology, 58(4), 346–355. https://doi.org/10.1016/j.jcjo.2022.02.010
Goldman, L.B. (2000). Cecil Textbook of Medicine (21st Edition).
Goroll. A. H., May, L.A., & Mulley, A.G. (2000). Primary Care Medicine: Office Evaluation and Management of the Adult Patient. Lippincott Williams & Wilkins.
Gurnani, B., & Kaur, K. (2024). Pigment Dispersion Syndrome. In StatPearls. StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK580526/
Helmer, C., Malet, F., Rougier, M., Schweitzer, C., Colin, J., Delyfer, M., Korobelnik, J., Barberger‐Gateau, P., Dartigues, J., & Delcourt, C. (2013). Is there a link between open‐angle glaucoma and dementia?: The Three‐City–Alienor Cohort. Annals of Neurology, 74(2), 171–179. https://doi.org/10.1002/ana.23926
Hirsch, M., & Birnbaum, R. (2023). Selective serotonin reuptake inhibitors: Pharmacology, administration, and side effects. UpToDate, Inc.
Huffman, James. (2024). What is Hyphema? American Academy of Ophthalmology. https://www.aao.org/eye-health/diseases/what-is-hyphema#:~:text=A%20hyphema%20is%20when%20blood,the%20middle%20of%20your%20eye).
Hulsman, C. A. A. (2001). Is Open-Angle Glaucoma Associated with Early Menopause? : The Rotterdam Study. American Journal of Epidemiology, 154(2), 138–144. https://doi.org/10.1093/aje/154.2.138
Illis, L. S. (1998). Harrison’s Principles of Internal Medicine 14th Edition: Edited by: A Fauci, E Braunwald, K Isselbacher, J Wilson, J Martin, D Kasper, S Hauser, D Longo. Spinal Cord, 36(9), 665–665. https://doi.org/10.1038/sj.sc.3100671
Jain, S., & Aref, A. (2015). Senile dementia and glaucoma: Evidence for a common link. Journal of Ophthalmic and Vision Research, 10(2), 178.
Kavitha, S., Zebardast, N., Palaniswamy, K., Wojciechowski, R., Chan, E. S., Friedman, D. S., Venkatesh, R., & Ramulu, P. Y. (2014). Family History Is a Strong Risk Factor for Prevalent Angle Closure in a South Indian Population. Ophthalmology, 121(11), 2091–2097. https://doi.org/10.1016/j.ophtha.2014.05.001
Khazaeni, B., Zeppieri, M., & Khazaeni, L. (2024). Acute Angle-Closure Glaucoma. In StatPearls. StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK430857/
Ko, Y.-C., Liu, C.-J., Hwang, D.-K., Chen, T.-J., & Liu, C. J. (2014). Increased Risk of Acute Angle Closure in Retinitis Pigmentosa: A Population-Based Case-Control Study. PLoS ONE, 9(9), e107660. https://doi.org/10.1371/journal.pone.0107660
Kreft, D., Doblhammer, G., Guthoff, R. F., & Frech, S. (2019). Prevalence, incidence, and risk factors of primary open-angle glaucoma—A cohort study based on longitudinal data from a German public health insurance. BMC Public Health, 19(1), 851. https://doi.org/10.1186/s12889-019-6935-6
Li, Y., Mitchell, W., Elze, T., & Zebardast, N. (2021). Association Between Diabetes, Diabetic Retinopathy, and Glaucoma. Current Diabetes Reports, 21(10), 38. https://doi.org/10.1007/s11892-021-01404-5
Lin, H.-C., Chien, C.-W., Hu, C.-C., & Ho, J.-D. (2010). Comparison of Comorbid Conditions between Open-Angle Glaucoma Patients and a Control Cohort. Ophthalmology, 117(11), 2088–2095. https://doi.org/10.1016/j.ophtha.2010.03.003
Madjedi, K. M., Stuart, K. V., Chua, S. Y. L., Foster, P. J., Strouthidis, N. G., Luben, R. N., Warwick, A. N., Kang, J. H., Wiggs, J. L., Pasquale, L. R., & Khawaja, A. P. (2022). The Association of Female Reproductive Factors with Glaucoma and Related Traits. Ophthalmology Glaucoma, 5(6), 628–647. https://doi.org/10.1016/j.ogla.2022.06.003
Mitchell, P., Smith, W., Chey, T., & Healey, P. R. (1997). Open-angle Glaucoma and Diabetes. Ophthalmology, 104(4), 712–718. https://doi.org/10.1016/S0161-6420(97)30247-4
Parivadhini, A., & Lingam, V. (2014). Management of Secondary Angle Closure Glaucoma. Journal of Current Glaucoma Practice, 8(1), 25–32. https://doi.org/10.5005/jp-journals-10008-1157
Quigley, H. A., & Broman, A. T. (2006). The number of people with glaucoma worldwide in 2010 and 2020. British Journal of Ophthalmology, 90(3), 262–267.
Razeghinejad, M. R., Pro, M. J., & Katz, L. J. (2011). Non-steroidal drug-induced glaucoma. Eye, 25(8), 971–980.
Rho, D. S. (2000). Acute angle-closure glaucoma after albuterol nebulizer treatment. American Journal of Ophthalmology, 130(1), 123–124. https://doi.org/10.1016/S0002-9394(00)00465-7
Roberti, G., Oddone, F., Agnifili, L., Katsanos, A., Michelessi, M., Mastropasqua, L., Quaranta, L., Riva, I., Tanga, L., & Manni, G. (2020). Steroid-induced glaucoma: Epidemiology, pathophysiology, and clinical management. Survey of Ophthalmology, 65(4), 458–472. https://doi.org/10.1016/j.survophthal.2020.01.002
Rossetti, L., Digiuni, M., Giovanni, M., Centofanti, M., Fea, A. M., Iester, M., Frezzotti, P., Figus, M., Ferreras, A., Oddone, F., Tanga, L., Rolle, T., Battaglino, V., Posarelli, C., Motolese, I., Mittica, P., Bagaglia, S. A., Menicacci, C., De Cilla’, S., … Fogagnolo, P. (2015). Blindness and Glaucoma: A Multicenter Data Review from 7 Academic Eye Clinics. PLOS ONE, 10(8), e0136632.
Shaikh, N., Srishti, R., Khanum, A., Thirumalesh, M., Dave, V., Arora, A., Bansal, R., Surve, A., Azad, S., & Kumar, V. (2023). Vitreous hemorrhage – Causes, diagnosis, and management. Indian Journal of Ophthalmology, 71(1), 28. https://doi.org/10.4103/ijo.IJO_928_22
Shin, D. Y., Jung, K. I., Park, H. Y. L., & Park, C. K. (2021). The effect of anxiety and depression on progression of glaucoma. Scientific Reports, 11(1), 1769. https://doi.org/10.1038/s41598-021-81512-0
Song, B. J., Aiello, L. P., & Pasquale, L. R. (2016). Presence and Risk Factors for Glaucoma in Patients with Diabetes. Current Diabetes Reports, 16(12), 124. https://doi.org/10.1007/s11892-016-0815-6
Stein, J. D., Khawaja, A. P., & Weizer, J. S. (2021). Glaucoma in Adults—Screening, Diagnosis, and Management: A Review. JAMA, 325(2), 164. https://doi.org/10.1001/jama.2020.21899
Subak-Sharpe, I., Low, S., Nolan, W., & Foster, P. J. (2010). Pharmacological and environmental factors in primary angle-closure glaucoma. British Medical Bulletin, 93(1), 125–143. https://doi.org/10.1093/bmb/ldp042
Symes, R. J., Etminan, M., & Mikelberg, F. S. (2015). Risk of Angle-Closure Glaucoma With Bupropion and Topiramate. JAMA Ophthalmology, 133(10), 1187. https://doi.org/10.1001/jamaophthalmol.2015.2180
Toprimate. (2024). Elsevier.
Trubnik, V. (2022). Primary Open Angle Glaucoma. In DynaMed. EBSCO Information Services. https://www.dynamed.com/condition/primary-open-angle-glaucoma-1/about
Trubnik, V. (2024). Angle-closure Glaucoma. In DynaMed. EBSCO Information Services. https://www.dynamed.com/condition/angle-closure-glaucoma#GUID-D4D97BFF-E394-4C20-BFDC-BE8A71ACF3E3
Ulhaq, Z. S. (2020). The association of estrogen-signaling pathways and susceptibility to open-angle glaucoma. Beni-Suef University Journal of Basic and Applied Sciences, 9(1), 7. https://doi.org/10.1186/s43088-020-0034-8
Vajaranant, T. S., Grossardt, B. R., Maki, P. M., Pasquale, L. R., Sit, A. J., Shuster, L. T., & Rocca, W. A. (2014). Risk of glaucoma after early bilateral oophorectomy. Menopause, 21(4), 391–398. https://doi.org/10.1097/GME.0b013e31829fd081
Valenzuela, C. V., Liu, J. C., Vila, P. M., Simon, L., Doering, M., & Lieu, J. E. C. (2019). Intranasal Corticosteroids Do Not Lead to Ocular Changes: A Systematic Review and Meta‐analysis. The Laryngoscope, 129(1), 6–12. https://doi.org/10.1002/lary.27209
Vinokurtseva, A., Fung, M., Ai Li, E., Zhang, R., Armstrong, J. J., & Hutnik, C. M. L. (2022). Impact of Inhaled and Intranasal Corticosteroids Exposure on the Risk of Ocular Hypertension and Glaucoma: A Systematic Review and Meta-Analysis. Clinical Ophthalmology (Auckland, N.Z.), 16, 1675–1695. https://doi.org/10.2147/OPTH.S358066
Veterans Affairs Canada (2024). Eye Anatomy. License purchased for use from Human Eye Anatomy Vector Illustration Royalty Free SVG, Cliparts, Vectors, and Stock Illustration. Image 85721345. (123rf.com)
Wang, Y., & Chan, C.-C. (2014). Gender Differences in Vogt-Koyanagi-Harada Disease and Sympathetic Ophthalmia. Journal of Ophthalmology, 2014, 1–8. https://doi.org/10.1155/2014/157803
Weizer, J. (2023). Angle-Closure Glaucoma. In UpToDate.
World Health Organization. (2019). International statistical classification of diseases and related health problems (11th Revision). https://icd.who.int/
Xu, Y., Phu, J., Aung, H. L., Hesam-Shariati, N., Keay, L., Tully, P. J., Booth, A., Anderson, C. S., Anstey, K. J., & Peters, R. (2023). Frequency of coexistent eye diseases and cognitive impairment or dementia: A systematic review and meta-analysis. Eye, 37(15), 3128–3136. https://doi.org/10.1038/s41433-023-02481-4
Yanoff. M., & Duker, J.S. (1999). Ophthalmology. Mosby.
Zhang, X., Liang, Y., Huang, Y., Liu, S., Li, Q., Wang, S., Wu, G., Du, Z., Wang, Y., Wang, J., Hu, Y., Zang, S., Hu, Y., Shang, X., Zhang, X., Zhang, L., Brown, A., Zhu, Z., He, M., & Yu, H. (2024). Evaluation of the Observational Associations and Shared Genetics Between Glaucoma With Depression and Anxiety. Investigative Opthalmology & Visual Science, 65(3), 12. https://doi.org/10.1167/iovs.65.3.12
Zhang, Y., Hao, J., Zhang, Q., Wang, J., Li, S. Z., Thomas, R., Wang, N. L., & The Handan Eye Study Group. (2023). Five‐year incidence of primary glaucoma and related risk factors – The Handan eye study. Acta Ophthalmologica, 101(1). https://doi.org/10.1111/aos.15216
Zhao, D., Cho, J., Kim, M. H., Friedman, D. S., & Guallar, E. (2015). Diabetes, Fasting Glucose, and the Risk of Glaucoma. Ophthalmology, 122(1), 72–78. https://doi.org/10.1016/j.ophtha.2014.07.051
Zhao, D., Cho, J., Kim, M. H., & Guallar, E. (2014). The Association of Blood Pressure and Primary Open-Angle Glaucoma: A Meta-analysis. American Journal of Ophthalmology, 158(3), 615-627.e9. https://doi.org/10.1016/j.ajo.2014.05.029