Ligne directrice sur l’admissibilité (LDA)
Date de révision : 22 janvier 2025
Date de création : avril 2006
Code CIM-11 : AB52
Code médical d'ACC : 00646 hypoacousie
Cette publication est disponible dans d'autres formats sur demande.
Document complet – Version PDF
Définition
On répartit les cas d’hypoacousie en trois grands types, en fonction du site anatomique :
- Surdité de perception (parfois appelée surdité neurosensorielle) : perte auditive due à un défaut dans la cochlée ou au niveau de la partie cochléaire ou vestibulaire du nerf auditif (huitième nerf crânien) qui réduit les impulsions nerveuses de la cochlée vers le cerveau.
- Surdité de transmission : perte auditive due à une altération de la conduction des sons du conduit auditif externe à l’oreille moyenne.
- Surdité mixte : perte auditive due à une combinaison de surdité de perception et de surdité de transmission.
Remarque : Aux fins de l’admissibilité à Anciens Combattants Canada (ACC) :
- Au moment de la présentation de la demande, l’hypoacousie du demandeur doit être chronique et source d’invalidité (la définition de ce diagnostic se trouve dans la norme diagnostique ci-dessous) pour que l’on envisage l’admissibilité. L’affection est jugée « chronique » si elle est présente depuis au moins six mois; les signes et symptômes tendent généralement à persister malgré les soins médicaux prodigués, mais à des degrés qui peuvent fluctuer au cours des six premiers mois et par la suite.
- Un diagnostic d’hypoacousie doit être posé, quel qu’en soit le type.
- Le vertige, la perte auditive ou les acouphènes peuvent faire partie du groupe de symptômes d’une affection médicale diagnostiquée, ou ils peuvent faire partie d’une affection médicale diagnostiquée primaire et indépendante. Chez les personnes qui présentent des symptômes de vertige, de perte auditive ou d’acouphènes, mais dont la cause est connue, ces symptômes sont compris dans la détermination de l’admissibilité et l’évaluation de l’affection. Avant de statuer sur la détermination de l’admissibilité et l’évaluation du vertige, de la perte auditive ou des acouphènes, ou d’une affection diagnostiquée qui peut causer ces symptômes, il faut procéder à un examen approfondi des affections précédemment admissibles et dont les symptômes se chevauchent.
Norme diagnostique
Diagnostic
Le diagnostic d’un médecin compétent en la matière (spécialiste des oreilles, du nez et de la gorge, soit un oto-rhino-laryngologiste [ORL], neurologue ou médecin de famille), d’une infirmière praticienne ou d’un audiologiste est requis.
Définitions des diagnostics
Les définitions de diagnostic ci-dessous figurent dans la politique d’ACC sur l’hypoacousie et les acouphènes. Pour plus de détails, veuillez consulter cette politique.
Audition normale
- Selon des normes généralement acceptées, l’audition est considérée comme normale lorsque la perte auditive est de 0 et 25 décibels (dB) à toutes les fréquences situées entre 250 et 8 000 Hz (inclusivement).
Hypoacousie
- Pour les besoins d’ACC, l’hypoacousie est une perte auditive supérieure à 25 dB aux fréquences situées entre 250 et 8 000 Hz (inclusivement), lorsque cette perte n’est pas suffisante pour correspondre à la définition d’hypoacousie entraînant une invalidité d’ACC, telle que décrite ci-dessous.
- Lorsqu’il est déterminé qu’une hypoacousie a été enregistrée pendant le service ou à la libération et/ou que le service semble être, selon toute vraisemblance, le facteur déclencheur contributif de l’hypoacousie actuelle entraînant une invalidité, on peut accorder l’admissibilité aux prestations d’invalidité.
Dans le cas d’une audition normale pendant le service, toute hypoacousie qui survient après le service est considérée comme étant d’origine post-libératoire et n’est pas considérée comme étant liée au service.
Remarque : Au moment de la publication de la présente ligne directrice sur l’admissibilité (LDA), l’avis des experts en santé et les données scientifiques indiquent que les surdités de perception liées à l’exposition au bruit cessent d’évoluer une fois l’exposition au bruit terminée.
- Dans certains cas, comme dans celui des demandes présentées à titre posthume, relativement au service pendant la Seconde Guerre mondiale ou dans des circonstances médicales exceptionnelles, il arrive que l’on ne dispose pas d’audiogrammes réalisés pendant le service ou d’audiogrammes à jour aux fins de la détermination de l’admissibilité. Ces situations sont traitées dans la politique sur l’hypoacousie et les acouphènes.
Hypoacousie entraînant une invalidité
- Pour les besoins d’ACC, il y a hypoacousie entraînant une invalidité lorsqu’un audiogramme indique une perte auditive totale en décibels (DSHL), dans une oreille ou l’autre, égale ou supérieure à 100 dB aux fréquences de 500, 1 000, 2 000 et 3 000 Hz ou une perte auditive, dans les deux oreilles, égale ou supérieure à 50 dB, à une fréquence de 4 000 Hz.
Considérations relatives au diagnostic
Les audiogrammes doivent être réalisés par un audiologiste clinicien autorisé, certifié ou agréé ou un médecin et soumis à la détermination de l’admissibilité ou à l’évaluation du Ministère. Les normes en ce qui concerne ces audiogrammes figurent ci-dessous. Les examens provenant d’autres sources, notamment un spécialiste en prothèses auditives, peuvent être étudiés par ACC s’ils respectent ces normes et sont cosignés par un audiologiste ou un médecin :
- Il faut procéder, pour les deux oreilles, à des épreuves auditives aux fréquences de 250, 500, 1 000, 2 000, 3 000, 4 000, 6 000 et 8 000 Hz.
- Les valeurs de conduction aérienne et osseuse des deux oreilles doivent figurer dans l’audiogramme.
- Les seuils d’intelligibilité des deux oreilles doivent figurer dans l’audiogramme.
- Il faut indiquer la fiabilité de l’audiogramme.
- La description narrative des résultats d’examens pourrait également être fournie.
Le responsable de la détermination pourra utiliser les audiogrammes qui ne satisfont pas à ces normes selon son jugement, au cas par cas. On détermine la fiabilité d’un audiogramme d’après l’interprétation des renseignements qu’il contient, sa date (il doit préférablement avoir été réalisé dans les deux dernières années) et sa concordance avec les audiogrammes réalisés antérieurement.
Lorsque le seuil auditif mesuré par audiogramme diminue, cette diminution peut être temporaire ou permanente. On appelle le décalage enregistré soit « déplacement temporaire du seuil » (DTS), soit « déplacement permanent du seuil » (DPS). Dans bien des cas, le DTS qui survient immédiatement après une exposition se rétablit avec le temps. Seule l’hypoacousie permanente est admissible, et l’établissement de celle-ci peut nécessiter plusieurs audiogrammes.
On peut effectuer des tests de la réponse auditive du tronc cérébral pour confirmer la fiabilité des audiogrammes.
Remarque : Les anciens audiogrammes utilisent parfois les valeurs prévues par la norme de l’Acoustical Society of America (ASA). Pour convertir l’hypoacousie selon l’ASA aux niveaux de la norme de l’Organisation internationale de normalisation (ISO) ou l’American National Standards Institute (ANSI), veuillez consulter l’Annexe A : Conversion ASA en ISO-ANSI.
Anatomie et physiologie
L’audition est le traitement et l’interprétation du son par le cerveau. L’oreille et le nerf vestibulocochléaire recueillent le son, le convertissent en impulsions électriques, puis transmettent ces impulsions au cerveau. Une affection à n’importe quel point le long de ce parcours, du pavillon de l’oreille au cerveau, peut entraîner une hypoacousie.
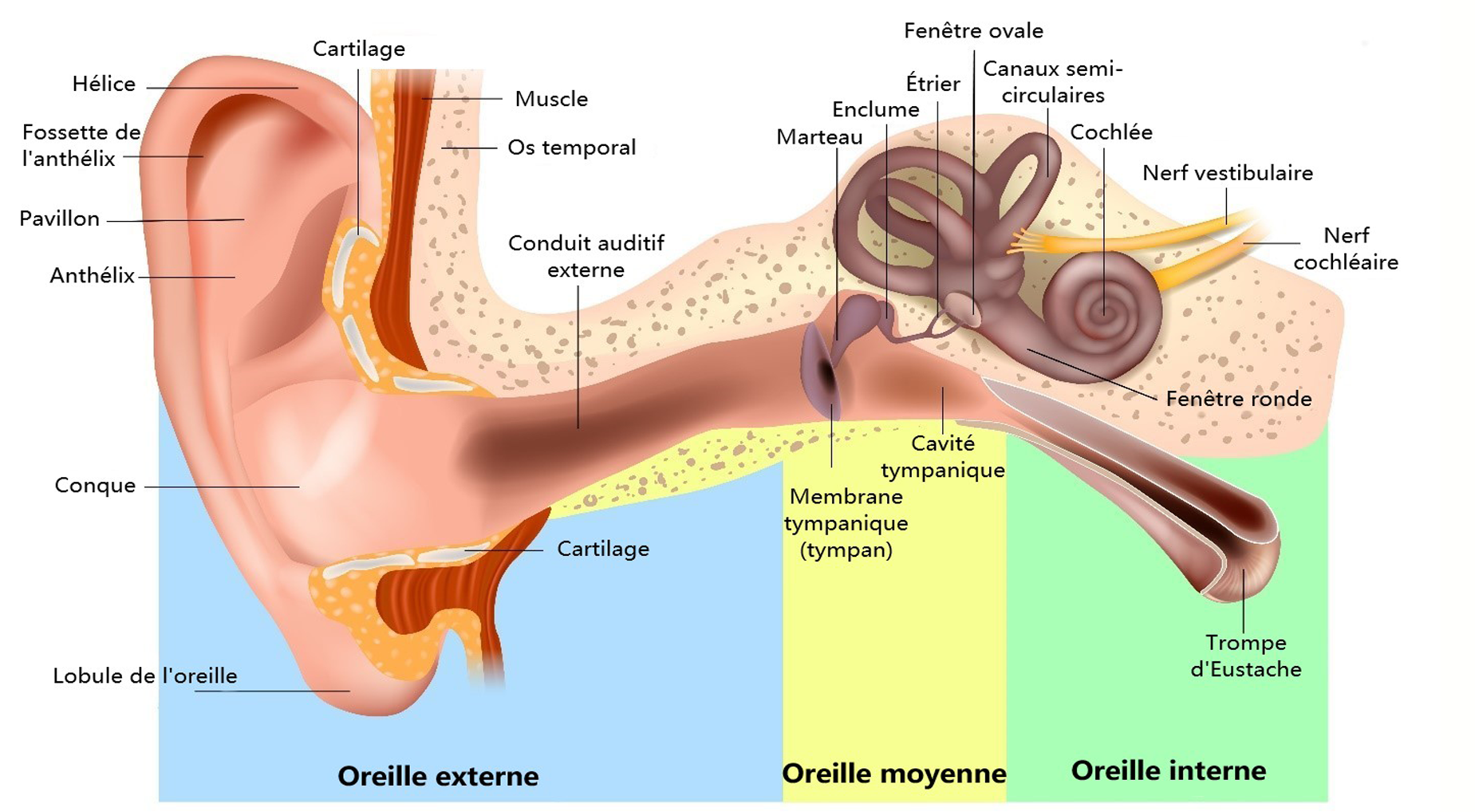
Les sons sont recueillis par le pavillon et transmis le long du conduit auditif externe, puis la membrane tympanique, ou le tympan, se met en mouvement (Figure 1 : Anatomie de l’oreille). Le tympan sépare le conduit de l’oreille moyenne et de ses trois osselets : le malleus, également appelé marteau, incus également appelé enclume et stapes, également appelé étrier. Les vibrations du tympan sont captées et amplifiées par les osselets, puis transmises à la cochlée. L’ensemble de ce système, qui s’étend du pavillon à l’étrier, forme l’appareil de transmission de l’oreille.
Figure 1 : Anatomie de l’oreille
Les vibrations des osselets sont transmises indirectement au liquide contenu dans la cochlée. Le mouvement du liquide stimule les cellules ciliées de l’organe de Corti, situé dans la cochlée, ce qui entraîne la transmission d’impulsions électriques le long du nerf vestibulocochléaire, jusqu’au cerveau. L’ensemble de ce système, qui s’étend de la cochlée au cortex auditif, constitue l’appareil de perception.
Un audiogramme complet montre les seuils d’audition en conduction aérienne et en conduction osseuse.
Types d’hypoacousie :
La surdité de transmission découle d’une inefficacité de propagation des ondes sonores dirigées vers l’oreille interne, due à quelque interférence au niveau du conduit auditif externe, du tympan, de la chaîne ossiculaire, de la cavité de l’oreille moyenne, de la fenêtre ovale, de la fenêtre ronde ou de la trompe d’Eustache.
Dans le cas d’une surdité de transmission pure, l’oreille interne et les voies neurales ne sont pas endommagées. Toute anomalie du système, depuis le bouchon de cérumen obstruant le conduit auditif externe jusqu’à la fixation de l’étrier provoquée par l’otospongiose, peut entraîner une surdité de transmission.À l’audiogramme, l’audition en conduction aérienne est réduite, et l’audition en conduction osseuse est normale, c’est-à-dire que sa courbe est plus haute. Sur l’audiogramme, la courbe correspondant à la conduction aérienne est donc abaissée par rapport à celle représentant la conduction osseuse. La distance entre les deux courbes se nomme « écart aérien osseux ».
Toute anomalie dans les structures de l’appareil de perception peut mener à une surdité de perception . Il peut par exemple s’agir d’une atteinte cochléaire ou encore d’un schwannome vestibulaire ou « neurinome de l’acoustique ».
Sur un audiogramme, la conduction aérienne et la conduction osseuse sont modifiées de façon semblable; les deux lignes de graphique sont à peu près au même niveau, et il n’y a pas d’écart aérien osseux.
- La surdité mixte se produit lorsque la conduction aérienne et la conduction osseuse sont toutes deux diminuées, mais la perte en conduction aérienne est plus marquée. La courbe en conduction aérienne est donc abaissée par rapport à celle en conduction osseuse. On note un écart aérien osseux à l’audiogramme.
Caractéristiques cliniques
Exposition au bruit
L’exposition au bruit est une cause courante d’hypoacousie. Le mécanisme par lequel un bruit excessif provoque l’hypoacousie consiste en des lésions mécaniques directes aux cellules ciliées de l’organe de Corti, situé dans la cochlée. Pour causer des lésions à l’oreille susceptibles d’entraîner une hypoacousie, le bruit doit atteindre un certain degré et se prolonger un certain temps. L’hypoacousie peut être :
Temporaire : un DTS avec rétablissement complet de l’audition en quelques heures à quelques semaines. Un tel rétablissement est possible si les cellules ciliées de l’organe de Corti sont en mesure de se rétablir;
ou
- Permanente : un DPS avec perte auditive permanente. La perte auditive est permanente dans le cas où les cellules ciliées de l’organe de Corti sont incapables de se rétablir.
Il existe deux types distincts d’hypoacousie dont la cause est une exposition à du bruit excessif :
- La perte auditive due au bruit, qui est associée à une exposition répétée ou continue à des sons. Le degré de perte auditive, le cas échéant, est lié au niveau sonore et à la durée de l’exposition. L’exposition à un certain degré de bruit durant un certain temps porte atteinte aux cellules ciliées de l’organe de Corti dans une mesure qui empêche le rétablissement, ce qui entraîne une hypoacousie permanente.
- Le traumatisme acoustique, qui est associé à un seul épisode d’exposition à un niveau de bruit dangereux. Il peut s’agir d’un bruit d’impact associé à la collision de deux objets ou d’un bruit impulsif, c’est-à-dire la libération soudaine d’énergie par une explosion ou un tir d’arme. Il arrive que ces types de bruit soient assez intenses pour porter atteinte de façon permanente aux cellules ciliées de l’organe de Corti. Dans le cas d’un traumatisme acoustique découlant d’une lésion liée à une onde de choc (effet de souffle), des lésions physiques directes à l’appareil auditif, autres que l’atteinte aux cellules ciliées de l’organe de Corti, peuvent également être causées par le souffle. C’est ce que l’on appelle un traumatisme sonore aigu.
Les sons de fréquence basse semblent nettement mieux tolérés par l’oreille que ceux de fréquence moyenne et élevée. L’oreille est particulièrement vulnérable aux fréquences situées entre 2 000 et 4 000 Hz, voire 6 000 Hz. Ces fréquences sont probablement plus courantes en milieu industriel, en raison d’opérations diverses comme le martelage, l’estampage, le pressage, le chargement et le rivetage. Dans d’autres contextes, elles peuvent correspondre aux détonations d’explosifs ou d’armes à feu et à certains types de bruits d’aéronefs.
Le niveau d’isosonie ou d’intensité acoustique (mesuré en dB) et la durée de l’exposition permettent de déterminer si une exposition à un bruit excessif a eu lieu. Le dépassement des durées maximales d’exposition peut causer une hypoacousie. L’exposition continue à un bruit supérieur à 85 dB durant plus de 8 heures par jour peut causer une hypoacousie, et une exposition unique et intense à un bruit supérieur à 140 dB peut immédiatement porter atteinte à l’audition. Plus les dB augmentent, plus le risque de lésions dues au bruit apparaît rapidement. La fréquence de l’exposition au bruit, mesurée en cycles par secondes, ou Hz, est également une information importante, étant donné que les sons de fréquence élevée peuvent être plus dommageables que ceux de fréquence basse. Par exemple, les limites d’exposition en milieu de travail applicables au bruit au Canada répertorient les employeurs réglementés par le gouvernement fédéral par province.
Le premier signe de lésions dues au bruit est une chute de l’audition, ou encoche audiométrique, à l’une des fréquences élevées, habituellement à 4 000 ou à 6 000 Hz. Toutefois, cette encoche n’apparaît pas toujours sur la courbe audiométrique. Par exemple, elle peut passer inaperçue en raison des effets du vieillissement ou de l’exposition continue aux bruits.
Dans ce dernier cas, l’hypoacousie devient irréversible par suite des dommages permanents subis par les cellules ciliées de la cochlée. En effet, le maintien de l’exposition entraîne l’atteinte d’un nombre croissant de cellules ciliées, et l’hypoacousie, même si elle demeure plus marquée aux fréquences élevées, s’étend aux fréquences inférieures.
Au-delà d’une certaine intensité, le bruit est de nature explosive et provoque des lésions liées aux ondes de choc (« blast » ou « effet de souffle »).
- Surdité de perception : le souffle peut détacher la zone sensorielle de la cochlée (organe de Corti) de ses ancrages et causer une surdité de perception permanente et incurable.
Surdité de transmission : le souffle peut perforer le tympan et provoquer une surdité de transmission. Si l’atteinte auditive se limite à cette perforation, l’hypoacousie peut n’être que temporaire; si le tympan guérit, il est possible que l’audition redevienne normale. Le souffle peut endommager ou désarticuler la chaîne ossiculaire située dans l’oreille moyenne, provoquant ainsi une surdité de transmission possiblement permanente, à moins que l’oreille ne soit opérée avec succès.
Remarque : Toutes les combinaisons de lésions par effet de souffle sont possibles, de sorte que la surdité peut être de transmission, de perception ou mixte.
Hypoacousie liée à l’âge (presbyacousie)
L’hypoacousie liée à l’âge est une hypoacousie bilatérale associée au vieillissement. Dans la plupart des cas, l’affection touche les cellules sensorielles de la cochlée, mais elle peut comprendre une dysfonction de la transmission et une dysfonction centrale. L’hypoacousie liée à l’âge cause généralement une perte auditive dans les hautes fréquences, l’audiogramme montrant une courbe qui descend graduellement à mesure que la fréquence s’accroît. Avec l’évolution de l’hypoacousie, dans bien des cas, les signes d’encoche audiométrique disparaissent.
L’hypoacousie liée à l’âge touche plus de la moitié des adultes à compter de l’âge de 75 ans et presque tous les adultes âgés de 90 ans et plus. Elle est plus fréquente chez les personnes de sexe masculin que chez les personnes de sexe féminin.
Considérations liées à l’admissibilité
Dans la présente section
Section A : Causes et/ou aggravation
Aux fins de l’admissibilité à ACC, on considère que les facteurs suivants causent ou aggravent les conditions énumérées dans la section des définitions de la présente LDA, et peuvent être pris en considération avec les éléments de preuve pour aider à établir un lien avec le service. Les facteurs énumérés dans la section A ont été déterminés sur la base d’une analyse de la littérature scientifique et médicale actualisée, ainsi que des meilleures pratiques médicales fondées sur des données probantes. Des facteurs autres que ceux énumérés à la section A peuvent être pris en considération, mais il est recommandé de consulter un consultant en prestations d’ invalidité ou un conseiller médical.
Les conditions énoncées ci-dessous sont fournies à titre indicatif. Dans chaque cas, la décision doit être prise en fonction du bien-fondé de la demande et des éléments de preuve fournis.
Facteurs
Remarque : Sauf indication contraire, les facteurs suivants peuvent être associés à la surdité de perception, à la surdité de transmission et à la surdité mixte.
- Être âgé de plus de 50 ans au moment de l’apparition clinique ou de l’aggravation de la surdité de perception. L’hypoacousie liée à l’âge est la surdité de perception qui accompagne le vieillissement . Elle touche plus de la moitié des gens ayant atteint l’âge de 75 ans. Aux fins de l’admissibilité d’ACC, l’hypoacousie liée à l’âge est considérée comme multifactorielle et comprend l’hypoacousie due à une exposition importante au bruit.
Avoir subi une exposition intermittente ou continue à du bruit (traumatisme acoustique exclu) dont l’intensité et la durée ont pu causer une perte auditive totale de 100 dB ou plus à des fréquences de 500, 1 000, 2 000 et 3 000 Hz dans l’une ou l’autre oreille, ou de 50 dB ou plus dans les deux oreilles à 4 000 Hz, en concomitance avec l’apparition clinique ou l’aggravation de la surdité de perception ou juste avant.
Certaines variables peuvent être prises en considération, entre autres :
- le niveau du danger lié au bruit*
- la constance du danger lié au bruit (intermittent ou continu)*
- la durée de l’exposition au bruit*
- la présence ou l’absence d’une protection auriculaire adéquate
- l’emplacement du danger lié au bruit (p. ex. en espace clos ou ouvert).
Remarque : *veuillez consulter la section sur l’exposition au bruit ci-dessus.
Avoir vécu au moins un épisode de traumatisme acoustique juste avant l’apparition clinique ou l’aggravation de la surdité de perception. Les types d’exposition suivants peuvent entraîner un traumatisme acoustique :
- feux d’artifice
- musique forte
- machinerie lourde
- coups de feu
- ondes de choc (c.-à-d. les explosions de grenades, de mines ou de bombes).
Le traumatisme acoustique est causé par une exposition intense de courte durée à un bruit fort, qui porte soudainement atteinte aux cellules ciliées de l’organe de Corti et cause en général immédiatement des symptômes de surdité de perception, de la douleur (en raison de la force du bruit) ou des acouphènes dans l’oreille ou les oreilles affectées. Ces symptômes, y compris la surdité de perception, peuvent se résorber en quelques jours. Une hypoacousie toujours présente huit semaines après l’exposition pourrait s’avérer permanente.
- Avoir vécu au moins un épisode de traumatisme sonore aigu juste avant l’apparition clinique ou l’aggravation de la surdité de perception, de transmission ou mixte. Le traumatisme sonore aigu est causé par l’exposition à une explosion qui entraîne l’atteinte physique soudaine de toute partie de l’oreille moyenne ou de l’oreille interne. Un traumatisme sonore aigu peut causer les affections suivantes :
- Atteinte permanente de la membrane tympanique ayant pour résultat une hypoacousie de transmission.
- Atteinte des osselets ayant pour résultat une hypoacousie de transmission.
- Atteinte de l’organe de Corti ayant pour résultat immédiat des symptômes de surdité de perception, de la douleur ou des acouphènes dans l’oreille ou les oreilles affectées. Ces symptômes, y compris la surdité de perception, peuvent se résorber en quelques jours. Une hypoacousie toujours présente huit semaines après l’exposition pourrait s’avérer permanente.
Avoir subi une atteinte à l’oreille moyenne causée par une inégalité de la pression de l’air (sans lien avec le bruit) de part et d’autre de la membrane tympanique, connue sous le nom de barotraumatisme otique , dans les quelques 30 jours avant l’apparition clinique ou l’aggravation de l’hypoacousie. Le type d’hypoacousie dépend du site des lésions.
Un barotraumatisme de l’oreille peut survenir en cas de différence de pression de l’air entre l’oreille moyenne et l’environnement externe. Il peut se manifester par une sensation de pression dans les oreilles, de la douleur, des acouphènes et une hypoacousie. Le barotraumatisme de l’oreille est généralement associé à une dysfonction de la trompe d’Eustache. Normalement, l’air qui entre dans l’oreille moyenne est absorbé par la muqueuse et évacué par la trompe d’Eustache.
Si la trompe d’Eustache est obstruée, il y a baisse de pression dans l’oreille moyenne et rétraction de la membrane tympanique. Par suite de son étirement, des saignements ou des hématomes peuvent toucher la membrane tympanique, du liquide peut se retrouver dans l’oreille moyenne, et il arrive que la membrane se rompe. Une telle atteinte de la membrane et de l’oreille moyenne peut causer une surdité de transmission.
Les lésions peu sévères, dont la plupart des ruptures de la membrane, guérissent généralement avec le temps. Il arrive que des lésions sévères touchent jusqu’aux structures de l’oreille moyenne. Il arrive, quoique rarement, que le barotraumatisme otique se complique d’une surdité de perception; dans ce cas, celles-ci est généralement associée à une fistule périlymphatique. Les fistules pélymphatique surviennent lorsque la fine membrane de la fenêtre ovale ou de la fenêtre ronde est perturbée par un traumatisme, ce qui entraîne une fuite de liquide du labyrinthe dans l'oreille moyenne provoquant généralement des symptômes des vertiges et des acouphènes.
Les types d’exposition suivants peuvent causer un barotraumatisme de l’oreille :
- déplacement en aéronef
- parachutisme
- plongée sous-marine
- travail dans un sous-marin
- oxygénothérapie hyperbare ou traitement en caisson hypobare
- claque sur l’oreille externe.
- Avoir une surdité de perception d’apparition soudaine (surdité brusque) idiopathique au moment de l’apparition clinique ou l’aggravation de la surdité de perception. Ce type d’hypoacousie est caractérisé par une diminution de la perception auditive d’au moins 30 dB en 72 heures. Certaines causes de surdité brusque sont connues : il arrive qu’elles surviennent à la suite d’une infection virale ou en cas de maladie auto-immune, de prise de médicaments, de troubles vasculaires ou de traumatisme. La surdité n’est alors pas idiopathique.
- Avoir eu une otite externe chronique avec obstruction du conduit auditif externe du côté affecté juste avant l’apparition clinique ou l’aggravation de la surdité de transmission. L’otite externe maligne est un exemple d’otite externe chronique pouvant provoquer une surdité de transmission permanente.
- Avoir eu une otite moyenne chronique du côté atteint, juste avant l’apparition clinique ou l’aggravation de la surdité de transmission. L’otite moyenne chronique peut provoquer :
- une perforation de la membrane tympanique (généralement, une perforation mineure guérit spontanément)
- une fibrose du méat moyen
- une érosion des osselets et de la membrane tympanique.
- Avoir eu une otite moyenne aiguë suppurée du côté atteint, juste avant l’apparition clinique ou l’aggravation de la surdité de transmission. La douleur est le principal symptôme évoqué. Du pus s’accumule dans l’oreille moyenne et le tympan est bombé. S’il y a rupture du tympan, une surdité de transmission survient immédiatement. Un traitement adéquat permet habituellement un rétablissement complet de l’ouïe. La perforation peut persister, avec ou sans traitement. L’ouïe peut redevenir normale ou garder des séquelles; tout dépend de l’ampleur et de l’emplacement de la perforation.
- Avoir eu une otite moyenne non suppurée du côté atteint, juste avant l’apparition clinique ou l’aggravation de la surdité de transmission. Cette affection se caractérise par la présence, dans l’oreille moyenne, d’un liquide séreux ou muqueux. Il y a une surdité de transmission pouvant être réversible par traitement; en l’absence d’un traitement, l’affection peut toutefois évoluer jusqu’à une otite adhésive, autrement dit, jusqu’à la formation, dans l’oreille moyenne, de zones cicatricielles associées à une surdité de transmission permanente. Cette affection est aussi appelée, entre autres, « otite moyenne catarrhale », « otite moyenne séreuse » et « otite moyenne avec épanchement ».
- Avoir eu une labyrinthite suppurée de l’oreille atteinte dans les 30 jours environ avant l’apparition clinique ou l’aggravation de la surdité de perception. Une labyrinthite suppurée est une inflammation du labyrinthe (un réseau de canaux interreliés situés dans l’oreille interne) caractérisée par la formation de pus.
- Avoir eu une blessure pénétrante à l’oreille moyenne du côté affecté dans les sept jours environ avant l’apparition clinique ou l’aggravation de la surdité de transmission. Une telle blessure suppose l’introduction d’un corps étranger tel qu’une arme, un bâton, une balle, un éclat d’obus ou un instrument à l’intérieur de la cavité tympanique.
- Avoir une obstruction permanente du conduit auditif externe, du côté atteint, au moment de l’apparition clinique ou de l’aggravation de la surdité de transmission.
- Avoir un granulome envahissant avec obstruction du conduit auditif externe du côté affecté au moment de l’apparition clinique ou de l’aggravation de la surdité de transmission. Les granulomes à corps étranger, tuberculeux ou sarcoïdosiques en sont des exemples.
Avoir eu une tumeur bénigne ou maligne touchant l’appareil auditif du côté atteint avant l’apparition clinique ou l’aggravation de l’hypoacousie. On entend par tumeur bénigne ou maligne une tumeur (néoplasme) primaire ou secondaire du nerf auditif, de l’oreille interne, de l’os temporal, de l’angle pontocérébelleux ou de la fosse crânienne postérieure (c.-à-d. la partie du crâne abritant le rhombencéphale), laquelle contient le cervelet, le pont et le bulbe rachidien.
Néoplasme : Tumeur primaire ou secondaire envahissant l’oreille moyenne ou entraînant, du côté atteint, l’obstruction d’au moins 90 % du conduit auditif externe, au moment de l’apparition clinique ou de l’aggravation de la surdité de transmission. Le néoplasme entraîne une surdité de transmission en influant sur les mécanismes mobiles de l’oreille moyenne et des osselets ou en obstruant le conduit auditif.
Les tumeurs peuvent affecter principalement l’oreille moyenne, la mastoïde et l’os temporal.
Être traité par un médicament inscrit sur la liste ci-dessous au moment de l’apparition clinique ou de l’aggravation de la surdité de perception ou l’avoir été juste avant. Ainsi, parmi les traitements médicamenteux concernés, il y a entre autres :
- l’administration parentérale d’un antibiotique de type aminoglycoside, tel que :
- la gentamicine
- la streptomycine
- la kanamycine
- l’amikacine
- la nétilmicine
- la tobramycine.
- l’administration intraveineuse :
- d’acide éthacrynique
- de bumétanide
- de vancomycine
- d’érythromycine.
- la chimiothérapie faisant appel aux agents suivants :
- moutarde à l’azote
- bléomycine
- cisplatine
- α difluorométhylornithine
- vincristine
- vinblastine
- misonidazole
- amino-6 nicotinamide
- carboplatine.
- si un traitement par le salicylate ou d’autres dérivés de la quinine est en cause au moment de l’apparition clinique ou de l’aggravation de l’hypoacousie, celle-ci disparaît généralement une fois le traitement terminé.
Remarques :
- Un médicament peut faire partie d’une famille de médicaments. Un médicament spécifique peut produire des effets différents de ceux de la classe à laquelle il appartient. Ce sont les effets du médicament lui-même qui devraient être pris en compte.
- S’il est déclaré qu’un médicament a causé l’apparition des signes cliniques ou l’aggravation de l’hypoacousie, il faut établir les faits suivants :
- Le médicament a été prescrit pour traiter une affection admissible.
- La personne recevait le médicament au moment de l’apparition des signes cliniques ou de l’aggravation de la surdité de perception.
- Selon la littérature médicale récente, le médicament peut entraîner l’apparition de signes cliniques ou l’aggravation de la surdité de perception.
- Le médicament est utilisé à long terme de façon continue et ne peut raisonnablement être remplacé par un autre médicament, ou le médicament est connu pour ses effets persistants après l’arrêt du traitement.
- l’administration parentérale d’un antibiotique de type aminoglycoside, tel que :
Avoir la maladie de Ménière au moment de l’apparition clinique ou de l’aggravation de la surdité de perception.
Remarque : Si le droit aux prestations d’invalidité est accordé pour la maladie de Ménière, l’hypoacousie a été incluse dans la détermination de l’admissibilité et l’évaluation de l’affection.
- Avoir un trouble systémique d’origine auto-immune au moment de l’apparition clinique ou de l’aggravation de la surdité de perception. En voici des exemples :
- granulomatose de Wegener
- syndrome de Cogan
- syndrome de Behçet
- polyarthrite rhumatoïde (veuillez consulter ci-dessous)
- lupus érythémateux disséminé
- périartérite noueuse.
- Avoir été atteint de polyarthrite rhumatoïde touchant une articulation synoviale quelconque de la tête ou du cou avant l’apparition clinique ou l’aggravation de la surdité de transmission. Les articulations situées entre le bloc incudo-malléaire et l’articulation incudo-stapédienne sont dites synoviales et sont donc, en de rares occasions, affectées par la polyarthrite rhumatoïde.
- Avoir eu des structures de l’appareil auditif affectées par la lèpre juste avant l’apparition clinique ou l’aggravation de la surdité de perception, de transmission ou mixte. La lèpre est une maladie infectieuse chronique à évolution lente provoquée par Mycobacterium leprae, qui touche principalement la peau et les nerfs périphériques, dont les nerfs sensoriels périphériques.
- Avoir une lésion vasculaire aiguë touchant les artères qui acheminent le sang vers la cochlée de l’oreille atteinte au moment de l’apparition clinique ou de l’aggravation de la surdité de perception.
- Avoir eu un syndrome d’hyperviscosité dans les 30 jours environ avant l’apparition clinique ou l’aggravation de la surdité de perception. Cela comprend :
- la macroglobulinémie de Waldenström
- la polycythémie
- les leucémies
- le myélome multiple
- le trait drépanocytaire.
- Avoir eu une infection virale aiguë parmi celles énumérées ci-dessous dans les 30 jours environ avant l’apparition clinique ou l’aggravation de la surdité de perception. Il s’agit généralement dans ce cas d’une surdité de perception d’apparition soudaine, l’hypoacousie évoluant rapidement en moins de 72 heures. Ces infections virales incluent, entre autres :
- la fièvre de Lassa
- les oreillons
- la rougeole
- la coqueluche
- la varicelle ou le zona.
- Avoir eu une méningite bactérienne dans les semaines ou les mois avant l’apparition clinique ou l’aggravation de la surdité de perception. La méningite bactérienne est une inflammation de l’enveloppe protectrice de l’encéphale et de la moelle épinière causée par une bactérie, dont les types les plus courants étant :
- la méningite à Haemophilus influenzae
- la méningite à méningocoques
- la méningite à pneumocoques
- la méningite tuberculeuse.
- Avoir été atteint de neurosyphilis avant l’apparition clinique ou l’aggravation de la surdité de perception. Il s’agit de manifestations, au niveau du système nerveux central, de la syphilis, une maladie infectieuse chronique subaiguë causée par le spirochète Treponema pallidum et caractérisée par des phases évolutives entrecoupées de périodes de latence. L’hypoacousie devrait survenir au cours d’une phase active de la maladie.
- Avoir eu une tuberculose ayant affecté l’os temporal du côté atteint avant l’apparition clinique ou l’aggravation de la surdité de perception.
- Avoir la maladie osseuse de Paget, des os touchant le crâne, au moment de l’apparition clinique ou de l’aggravation de la surdité de perception, de transmission ou mixte. Aussi appelée ostéite déformante, cette affection est une maladie osseuse caractérisée par des épisodes répétés de perte osseuse et de formation de nouvelle matière osseuse aboutissant à un remodelage osseux hypertrophié, fragilisé et difforme.
- Être atteint d’otospongiose au moment de l’apparition clinique ou de l’aggravation de la surdité de transmission. L’otospongiose est un trouble primaire de la capsule labyrinthique caractérisée par la formation de nouveaux os, le plus souvent sur la platine de l’étrier.
Avoir subi un traumatisme craniocérébral (TCC) modéré ou grave au moment de l’apparition clinique ou de l’aggravation de la surdité de perception. Il est important d’établir la chronologie de la survenue des affections.
Remarque : En ce qui concerne l’admissibilité relatif à l’hypoacousie causée par un TCC léger, il est recommandé de consulter un consultant en prestations d’invalidité ou un conseiller médical.
- Avoir subi un traumatisme crânien ayant entraîné une fracture de l’os temporal dans les semaines avant l’apparition clinique ou l’aggravation de l’hypoacousie. Les fractures transversales de l’os temporal sont susceptibles de porter atteinte au nerf cochléovestibulaire et ainsi d’entraîner une surdité de perception. Les fractures de l’os temporal peuvent aussi causer une surdité de transmission si la chaîne ossiculaire est atteinte.
Avoir participé à des séances de radiothérapie ayant affecté la cochlée ou le nerf cochléovestibulaire/acoustique avant l’apparition clinique ou l’aggravation de la surdité de perception.
Radiothérapie, alors que l’os temporal du côté atteint était dans le champ de rayonnement, avant l’apparition clinique ou l’aggravation de la surdité de transmission : l’ostéoradionécrose de l’os temporal peut provoquer une infection chronique et mener à une surdité de transmission.
La radiothérapie provoque la sécheresse et la desquamation de la peau du conduit auditif externe, entraînant l’accumulation de débris qui peuvent causer une surdité de transmission, ou la dysfonction de la trompe d’Eustache, accompagnée d’une otite moyenne séreuse. Ces effets se résorbent généralement une fois la radiothérapie terminée.
- Avoir un cholestéatome, une excroissance en forme de kyste provenant de l’oreille moyenne, du côté touché au moment de l’apparition clinique ou de l’aggravation de l’hypoacousie. Un cholestéatome acquis peut se développer à la suite d’une otite moyenne chronique ou d’une perforation de la membrane tympanique. Les cholestéatomes ont tendance à se développer et à s’étendre à l’os environnant et à la cavité mastoïdienne.
- Avoir une fente palatine au moment de l’apparition clinique ou de l’aggravation de la surdité de transmission.
- Incapacité d’obtenir un traitement médical approprié pour la surdité de perception, de transmission ou mixte.
Remarque : Au moment de la publication de la présente LDA, l’avis des experts en santé et les données scientifiques indiquent que les surdités de perception liées à l’exposition au bruit cessent d’évoluer une fois l’exposition au bruit terminée.
Section B : Affections dont il faut tenir compte dans la détermination de l’admissibilité/l’évaluation
La section B fournit une liste des affections diagnostiquées qu’ACC prend en considération dans la détermination de l’admissibilité et l’évaluation de l’hypoacousie.
- L’hypoacousie de tous types dans une oreille ayant droit à des prestations d’invalidité, qu’il s’agisse d’hypoacousie de perception, d’hypoacousie de transmission ou d’hypoacousie mixte. Cela comprend :
- l’hypoacousie liée à l’âge/la presbyacousie.
Section C : Affections courantes pouvant découler en totalité ou en partie de l’hypoacousie et/ou de son traitement
La section C est une liste des affections qui peuvent être causées ou aggravées par l’hypoacousie ou son traitement. On ne tient pas compte des conditions énumérées dans la section C pour ce qui est de la détermination de l’admissibilité et de l’évaluation de l’hypoacousie. Une décision d’admissibilité en raison d’une affection consécutive peut être prise si le bien-fondé de la demande le justifie et si les éléments de preuve médicale montrent l’existence d’une relation consécutive.
Des affections autres que celles énumérées dans la section C peuvent être prises en considération; il est recommandé de consulter un consultant en prestations d’invalidité ou un conseiller médical.
- Otite externe causée par le port de prothèses auditives
- Acouphènes
Remarque :
- Au moment de la publication de la présente LDA, l’avis des experts en santé et les données scientifiques ne permettent pas d’affirmer que l’hypoacousie cause ou aggrave la démence.
- La détermination de l’admissibilité et l’évaluation de l’invalidité découlant de l’hypoacousie comprend les difficultés de communication que peuvent éprouver les personnes atteintes d’hypoacousie. Aux fins de la détermination d’une admissibilité par ACC, ces difficultés de communication ne sont pas considérées comme causant une aggravation permanente de la démence.
- L’hypoacousie ne cause pas et n’aggrave pas de façon permanente la maladie de Ménière. On tient compte de l’hypoacousie dans la détermination de l’admissibilité relatif au syndrome de Ménière.
Annexe A : Conversion ASA en ISO-ANSI
Il importe de souligner que, selon la littérature, il est possible que les données audiométriques américaines recueillies avant 1969-1970 soient fondées sur la norme de l’ASA. Jusqu’en 1977, il était recommandé d’ajouter la mention ISO ou ANSI sur les formulaires d’audiogrammes afin que l’on sache que tous les niveaux d’audition inscrits dans les rapports étaient vraiment fondés sur l’une ou l’autre de ces normes (Hearing and Deafness, 4th ed., p. 287).
Liens
Directives et politiques connexes d’ACC :
- Acouphènes – Lignes directrices sur l’admissibilité
- Maladie de Ménière – Lignes directrices sur l’admissibilité
- Maladie osseuse de Paget (Ostéite déformante hypertrophique) – Lignes directrices sur l’admissibilité
- Otite moyenne chronique – Lignes directrices sur l’admissibilité
- Otospongiose – Lignes directrices sur l’admissibilité
- Polyarthrite rhumatoïde – Ligne directrice sur l’admissibilité
- Traumatisme craniocérébral – Lignes directrices sur l’admissibilité
- Troubles liés au vertige – Lignes directrices sur l’admissibilité
- Hypoacousie et acouphènes – Politiques
- Indemnité pour douleur et souffrance – Politiques
- Demandes de pension d'invalidité de la Gendarmerie royale canadienne – Politiques
- Admissibilité double – Prestations d’invalidité – Politiques
- Détermination d’une invalidité – Politiques
- Prestations d’invalidité versées à l’égard du service en temps de paix – Principe d’indemnisation – Politiques
- Prestations d’invalidité versées à l’égard du service en temps de guerre et du service spécial – Principe d’assurance – Politiques
- Invalidité consécutive à une blessure ou maladie non liée au service – Politiques
- Invalidité consécutive – Politiques
- Bénéfice du doute – Politiques
Références compter à 22 janvier 2025
Disponible en anglais seulement
Amieva, H., Ouvrard, C., Meillon, C., Rullier, L., & Dartigues, J.-F. (2018). Death, Depression, Disability, and Dementia Associated With Self-reported Hearing Problems: A 25-Year Study. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences, 73(10), 1383–1389. https://doi.org/10.1093/gerona/glx250
Andries, E., Bosmans, J., Engelborghs, S., Cras, P., Vanderveken, O. M., Lammers, M. J. W., Van de Heyning, P. H., Van Rompaey, V., & Mertens, G. (2023). Evaluation of Cognitive Functioning Before and After Cochlear Implantation in Adults Aged 55 Years and Older at Risk for Mild Cognitive Impairment. JAMA Otolaryngology-- Head & Neck Surgery, 149(4), 310–316. https://doi.org/10.1001/jamaoto.2022.5046
Armstrong, N. M., An, Y., Doshi, J., Erus, G., Ferrucci, L., Davatzikos, C., Deal, J. A., Lin, F. R., & Resnick, S. M. (2019). Association of Midlife Hearing Impairment With Late-Life Temporal Lobe Volume Loss. JAMA Otolaryngology—Head & Neck Surgery, 145(9), 794–802. https://doi.org/10.1001/jamaoto.2019.1610
Aronson, J. K. (Ed.). (2015). Meyler’s side effects of drugs: The international encyclopedia of adverse drug reactions and interactions (16. Ed). Elsevier.
Arts, H., & Adams, M. (2020). Sensorineural Hearing Loss in Adults in Cummings Otolarungology: Head and Neck Surgery. In Cummings Otolaryngology: Head and Neck Surgery. Elsevier Health Sciences.
Australian Government, Repatriation Medical Authority. (1996). Statement of Principles concerning conductive hearing loss (Balance of Probabilities) (No. 20 of 1996). SOPs - Repatriation Medical Authority
Australian Government, Repatriation Medical Authority. (1996). Statement of Principles concerning conductive hearing loss (Reasonable Hypothesis) (No. 19 of 1996). SOPs - Repatriation Medical Authority
Australian Government, Repatriation Medical Authority. (2001). Statement of Principles concerning sensorineural hearing loss (Balance of Probabilities) (No. 30 of 2001). SOPs - Repatriation Medical Authority
Australian Government, Repatriation Medical Authority. (2001). Statement of Principles concerning sensorineural hearing loss (Reasonable Hypothesis) (No. 29 of 2001). SOPs - Repatriation Medical Authority
Australian Government, Repatriation Medical Authority. (2019). Statement of Principles concerning conductive hearing loss (Balance of Probabilities)(No. 82 of 2019). SOPs - Repatriation Medical Authority
Australian Government, Repatriation Medical Authority. (2019). Statement of Principles concerning conductive hearing loss (Reasonable Hypothesis) (No. 81 of 2019). SOPs - Repatriation Medical Authority
Australian Government, Repatriation Medical Authority. (2019). Statement of Principles concerning sensorineural hearing loss (Balance of Probabilities) (No. 99 of 2019). SOPs - Repatriation Medical Authority
Australian Government, Repatriation Medical Authority. (2019). Statement of Principles concerning sensorineural hearing loss (Reasonable Hypothesis) (No. 98 of 2019). SOPs - Repatriation Medical Authority
Bergemalm, P.-O., & Lyxell, B. (2005). Appearances are deceptive? Long-term cognitive and central auditory sequelae from closed head injury. International Journal of Audiology, 44(1), 39–49. https://doi.org/10.1080/14992020400022546
Blevins, N. (2022). Presbycusis. UpToDate, Inc. https://www.dynamed.com/condition/presbycusis
Bohne, B. A., Kimlinger, M., & Harding, G. W. (2017). Time course of organ of Corti degeneration after noise exposure. Hearing Research, 344, 158–169. https://doi.org/10.1016/j.heares.2016.11.009
Chen, J. X., Lindeborg, M., Herman, S. D., Ishai, R., Knoll, R. M., Remenschneider, A., Jung, D. H., & Kozin, E. D. (2018). Systematic review of hearing loss after traumatic brain injury without associated temporal bone fracture. American Journal of Otolaryngology, 39(3), 338–344. https://doi.org/10.1016/j.amjoto.2018.01.018
Chern, A., & Golub, J. S. (2019). Age-related Hearing Loss and Dementia. Alzheimer Disease and Associated Disorders, 33(3), 285–290. https://doi.org/10.1097/WAD.0000000000000325
Dalgıç, A., Yılmaz, O., Hıdır, Y., Satar, B., & Gerek, M. (2015). Analysis of Vestibular
Evoked Myogenic Potentials and Electrocochleography in Noise Induced Hearing Loss. The Journal of International Advanced Otology, 11(2), 127–132. https://doi.org/10.5152/iao.2015.1025
Davis, H., & Silverman, S. R. (Eds.). (1978). Hearing and Deafness (4th edition). Holt, Rinehart & Winston.
Dawes, P., & Völter, C. (2023). Do hearing loss interventions prevent dementia? Zeitschrift Fur Gerontologie Und Geriatrie, 56(4), 261–268.
Deal, J. A., Betz, J., Yaffe, K., Harris, T., Purchase-Helzner, E., Satterfield, S., Pratt, S., Govil, N., Simonsick, E. M., Lin, F. R., & Health ABC Study Group. (2017). Hearing Impairment and Incident Dementia and Cognitive Decline in Older Adults: The Health ABC Study. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences, 72(5), 703–709. https://doi.org/10.1093/gerona/glw069
Department of Veterans Affairs, Canada (1997). A Review of Noise Induced Hearing Loss, Tinnitus and Evoked Response Audiometry.
Esquivel, C. R., Parker, M., Curtis, K., Merkley, A., Littlefield, P., Conley, G., Wise, S., Feldt, B., Henselman, L., & Stockinger, Z. (2018). Aural Blast Injury/Acoustic Trauma and Hearing Loss. Military Medicine, 183(suppl_2), 78–82. https://doi.org/10.1093/milmed/usy167
Fauci, A., Braunwald, E., Isselbacher, K., Wilson, J., Martin, J., Kasper, D., Hauser, S., & Longo, D. (1998). Harrison’s Principles of Internal Medicine 14th Edition. 36(9), 665–665. https://doi.org/10.1038/sj.sc.3100671
Ferrite, S., Santana, V. S., & Marshall, S. W. (2011). Validity of self-reported hearing loss in adults: Performance of three single questions. Revista De Saude Publica, 45(5), 824–830. https://doi.org/10.1590/s0034-89102011005000050
Flint, P. W., Haughey, B. H., Lund, V. J., Robbins, K. T., Thomas, J. R., Lesperance, M. M.,& Francis, H. W. (2020). Cummings Otolaryngology E-Book: Head and Neck Surgery, 3-Volume Set. Elsevier Health Sciences.
Gates, G. A., Schmid, P., Kujawa, S. G., Nam, B., & D’Agostino, R. (2000). Longitudinal threshold changes in older men with audiometric notches. Hearing Research, 141(1–2), 220–228. https://doi.org/10.1016/S0378-5955(99)00223-3
Guest, H., Munro, K. J., Prendergast, G., Howe, S., & Plack, C. J. (2017). Tinnitus with a normal audiogram: Relation to noise exposure but no evidence for cochlear synaptopathy. Hearing Research, 344, 265–274. https://doi.org/10.1016/j.heares.2016.12.002
Hafdi, M., Hoevenaar-Blom, M. P., & Richard, E. (2021). Multi-domain interventions for the prevention of dementia and cognitive decline. The Cochrane Database of Systematic Reviews, 11(11), CD013572. https://doi.org/10.1002/14651858.CD013572.pub2
Hammill, T. L., & Campbell, K. C. (2018). Protection for medication-induced hearing loss: The state of the science. International Journal of Audiology, 57(sup4), S87–S95. https://doi.org/10.1080/14992027.2018.1455114
Hanna, B. (2024). Vestibula Neuritis. In DynaMed. EBSCO Information Services. https://www.dynamed.com/condition/vestibular-neuritis/about
Helfer, T. M., Jordan, N. N., Lee, R. B., Pietrusiak, P., Cave, K., & Schairer, K. (2011). Noise-induced hearing injury and comorbidities among postdeployment U.S. Army soldiers: April 2003-June 2009. American Journal of Audiology, 20(1), 33–41. https://doi.org/10.1044/1059-0889(2011/10-0033)
Hirsch, M., & Birnbaum, R. (2023). Selective serotonin reuptake inhibitors: Pharmacology, administration, and side effects. UpToDate, Inc.
Jafari, Z., Kolb, B. E., & Mohajerani, M. H. (2022). Hearing Loss, Tinnitus, and Dizziness in COVID-19: A Systematic Review and Meta-Analysis. Canadian Journal of Neurological Sciences / Journal Canadien Des Sciences Neurologiques, 49(2), 184–195. https://doi.org/10.1017/cjn.2021.63
Jiang, F., Mishra, S. R., Shrestha, N., Ozaki, A., Virani, S. S., Bright, T., Kuper, H., Zhou, C., & Zhu, D. (2023). RETRACTED - Association between hearing aid use and all-cause and cause-specific dementia: An analysis of the UK Biobank cohort. The Lancet. Public Health, 8(5), e329–e338. https://doi.org/10.1016/S2468-2667(23)00048-8
Karch, S. J., Capó-Aponte, J. E., McIlwain, D. S., Lo, M., Krishnamurti, S., Staton, R. N., & Jorgensen-Wagers, K. (2016). Hearing Loss and Tinnitus in Military Personnel with Deployment-Related Mild Traumatic Brain Injury. U.S. Army Medical Department Journal, 3–16, 52–63.
Kliegman, R. M., & Geme, J. W. S. (2019). Nelson Textbook of Pediatrics E-Book. Elsevier Health Sciences.
Kuhn, M., Heman-Ackah, S. E., Shaikh, J. A., & Roehm, P. C. (2011). Sudden Sensorineural Hearing Loss: A Review of Diagnosis, Treatment, and Prognosis. Trends in Amplification, 15(3), 91–105. https://doi.org/10.1177/1084713811408349
Kujawa, S. G., & Liberman, M. C. (2006). Acceleration of Age-Related Hearing Loss by Early Noise Exposure: Evidence of a Misspent Youth. The Journal of Neuroscience, 26(7), 2115–2123. https://doi.org/10.1523/JNEUROSCI.4985-05.2006
Kurabi, A., Keithley, E. M., Housley, G. D., Ryan, A. F., & Wong, A. C.-Y. (2017). Cellular mechanisms of noise-induced hearing loss. Hearing Research, 349, 129–137. https://doi.org/10.1016/j.heares.2016.11.013
Lang, E. (2023). Dizziness in Adults—Approach to the Patient. In DynaMed. EBSCO Information Services.
Liberman, M. C., & Kujawa, S. G. (2017). Cochlear synaptopathy in acquired sensorineural hearing loss: Manifestations and mechanisms. Hearing Research, 349, 138–147. https://doi.org/10.1016/j.heares.2017.01.003
Lie, A., Skogstad, M., Johannessen, H. A., Tynes, T., Mehlum, I. S., Nordby, K.-C., Engdahl, B., & Tambs, K. (2016). Occupational noise exposure and hearing: A systematic review. International Archives of Occupational and Environmental Health, 89(3), 351–372. https://doi.org/10.1007/s00420-015-1083-5
Lin, F. R., Metter, E. J., O’Brien, R. J., Resnick, S. M., Zonderman, A. B., & Ferrucci, L. (2011). Hearing loss and incident dementia. Archives of Neurology, 68(2), 214–220. https://doi.org/10.1001/archneurol.2010.362
Lisko, I., Kulmala, J., Annetorp, M., Ngandu, T., Mangialasche, F., & Kivipelto, M. (2021). How can dementia and disability be prevented in older adults: Where are we today and where are we going? Journal of Internal Medicine, 289(6), 807–830. https://doi.org/10.1111/joim.13227
Liu, X., & Yan, D. (2007). Ageing and hearing loss. The Journal of Pathology, 211(2), 188–197. https://doi.org/10.1002/path.2102
Livingston, G., Huntley, J., Sommerlad, A., Ames, D., Ballard, C., Banerjee, S., Brayne, C., Burns, A., Cohen-Mansfield, J., Cooper, C., Costafreda, S. G., Dias, A., Fox, N., Gitlin, L. N., Howard, R., Kales, H. C., Kivimäki, M., Larson, E. B., Ogunniyi, A., … Mukadam, N. (2020). Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet (London, England), 396(10248), 413–446. https://doi.org/10.1016/S0140-6736(20)30367-6
Livingston, G., Sommerlad, A., Orgeta, V., Costafreda, S. G., Huntley, J., Ames, D., Ballard, C., Banerjee, S., Burns, A., Cohen-Mansfield, J., Cooper, C., Fox, N., Gitlin, L. N., Howard, R., Kales, H. C., Larson, E. B., Ritchie, K., Rockwood, K., Sampson, E. L., … Mukadam, N. (2017). Dementia prevention, intervention, and care. Lancet (London, England), 390(10113), 2673–2734. https://doi.org/10.1016/S0140-6736(17)31363-6
Loughrey, D. G., Kelly, M. E., Kelley, G. A., Brennan, S., & Lawlor, B. A. (2018). Association of Age-Related Hearing Loss With Cognitive Function, Cognitive Impairment, and Dementia: A Systematic Review and Meta-analysis. JAMA Otolaryngology—Head & Neck Surgery, 144(2), 115–126. https://doi.org/10.1001/jamaoto.2017.2513
Loughrey, D. G., Kelly, M. E., Kelley, G. A., Brennan, S., & Lawlor, B. A. (2018). Association of Age-Related Hearing Loss With Cognitive Function, Cognitive Impairment, and Dementia: A Systematic Review and Meta-analysis. JAMA Otolaryngology-- Head & Neck Surgery, 144(2), 115–126. https://doi.org/10.1001/jamaoto.2017.2513
Lustig, L., Limb, C., & Durand, M. (2023). Chronic Otitis Media and Cholesteatoma in Adults. UpToDate, Inc.
Marinelli, J. P., Lohse, C. M., Fussell, W. L., Petersen, R. C., Reed, N. S., Machulda, M. M., Vassilaki, M., & Carlson, M. L. (2022). Association between hearing loss and development of dementia using formal behavioural audiometric testing within the Mayo Clinic Study of Aging (MCSA): A prospective population-based study. The Lancet. Healthy Longevity, 3(12), e817–e824. https://doi.org/10.1016/S2666-7568(22)00241-0
Moore, B. C. J. (2021). The Effect of Exposure to Noise during Military Service on the Subsequent Progression of Hearing Loss. International Journal of Environmental Research and Public Health, 18(5), 2436. https://doi.org/10.3390/ijerph18052436
Mosnier, I., Bebear, J.-P., Marx, M., Fraysse, B., Truy, E., Lina-Granade, G., Mondain, M., Sterkers-Artières, F., Bordure, P., Robier, A., Godey, B., Meyer, B., Frachet, B., Poncet-Wallet, C., Bouccara, D., & Sterkers, O. (2015). Improvement of cognitive function after cochlear implantation in elderly patients. JAMA Otolaryngology-- Head & Neck Surgery, 141(5), 442–450. https://doi.org/10.1001/jamaoto.2015.129
Muhr, P., Månsson, B., & Hellström, P. A. (2006). A study of hearing changes among military conscripts in the Swedish Army: Estudio de los cambios auditivos en conscriptos de la Armada Sueca. International Journal of Audiology, 45(4), 247–251. https://doi.org/10.1080/14992020500190052
Nadhimi, Y., & Llano, D. A. (2021). Does hearing loss lead to dementia? A review of the literature. Hearing Research, 402, 108038. https://doi.org/10.1016/j.heares.2020.108038
Natarajan, N., Batts, S., & Stankovic, K. M. (2023). Noise-Induced Hearing Loss. Journal of Clinical Medicine, 12(6), 2347. https://doi.org/10.3390/jcm12062347
Newby, H. A., & Popelka, G. R. (1992). Audiology (6th ed). Prentice Hall; WorldCat.
Nolan, L. S. (2020). Age‐related hearing loss: Why we need to think about sex as a biological variable. Journal of Neuroscience Research, 98(9), 1705–1720. https://doi.org/10.1002/jnr.24647
Paparella, M. M., da Costa, S. S., & Fagan, J. (1991). Paparella’s Otolaryngology: Head & Neck Surgery: Two Volume Set (3rd ed). Jaypee Brothers Medical Publishers.
Pichora-Fuller, M. K., Schneider, B. A., & Daneman, M. (1995). How young and old adults listen to and remember speech in noise. The Journal of the Acoustical Society of America, 97(1), 593–608. https://doi.org/10.1121/1.412282
Powell, D. S., Oh, E. S., Reed, N. S., Lin, F. R., & Deal, J. A. (2021). Hearing Loss and Cognition: What We Know and Where We Need to Go. Frontiers in Aging Neuroscience, 13, 769405. https://doi.org/10.3389/fnagi.2021.769405
Priya, J. S., & Hohman, M. H. (2024). Noise Exposure and Hearing Loss. In StatPearls.
StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK594247/
Rosdina, A., Leelavathi, M., Zaitun, A., Lee, V., Azimah, M., Majmin, S., & Mohd, K. (2010). Self-reported hearing loss among elderly malaysians. Malaysian Family Physician: The Official Journal of the Academy of Family Physicians of Malaysia, 5(2), 91–94.
Rosenhall, U. (2015). Epidemiology of age-related hearing loss. Hearing, Balance and Communication, 13(2), 46–50. https://doi.org/10.3109/21695717.2015.1013775
Segal, S., Eviatar, E., Berenholz, L., Kessler, A., & Shlamkovitch, N. (2003a). Is There a Relation Between Acoustic Trauma or Noise-Induced Hearing Loss and a Subsequent Appearance of Ménière’s Disease?: An Epidemiologic Study of 17,245 Cases and a Review of the Literature: Otology & Neurotology, 24(3), 387391. https://doi.org/10.1097/00129492-200305000-00007
Senior, S. L. (2019). Health needs of ex-military personnel in the UK: A systematic review and qualitative synthesis. Journal of the Royal Army Medical Corps, 165(6), 410–415. https://doi.org/10.1136/jramc-2018-001101
Sonstrom Malowski, K., Gollihugh, L. H., Malyuk, H., & Le Prell, C. G. (2022). Auditory changes following firearm noise exposure, a review. The Journal of the Acoustical Society of America, 151(3), 1769–1791. https://doi.org/10.1121/10.0009675
Swords, G. M., Nguyen, L. T., Mudar, R. A., & Llano, D. A. (2018). Auditory system dysfunction in Alzheimer disease and its prodromal states: A review. Ageing Research Reviews, 44, 49–59. https://doi.org/10.1016/j.arr.2018.04.001
Talmi, Y. P., Finkelstein, Y., & Zohar, Y. (1991). Barotrauma-Induced Hearing Loss. Scandinavian Audiology, 20(1), 1–9. https://doi.org/10.3109/01050399109070783
Tang, D., Tran, Y., Dawes, P., & Gopinath, B. (2023). A Narrative Review of Lifestyle Risk Factors and the Role of Oxidative Stress in Age-Related Hearing Loss. Antioxidants, 12(4), 878. https://doi.org/10.3390/antiox12040878
Tang, D., Tran, Y., Dawes, P., & Gopinath, B. (2023). A Narrative Review of Lifestyle Risk Factors and the Role of Oxidative Stress in Age-Related Hearing Loss. Antioxidants (Basel, Switzerland), 12(4), 878. https://doi.org/10.3390/antiox12040878
Thomson, R. S., Auduong, P., Miller, A. T., & Gurgel, R. K. (2017). Hearing loss as a risk factor for dementia: A systematic review. Laryngoscope Investigative Otolaryngology, 2(2), 69–79. https://doi.org/10.1002/lio2.65
Tun, P. A., McCoy, S., & Wingfield, A. (2009). Aging, hearing acuity, and the attentional costs of effortful listening. Psychology and Aging, 24(3), 761–766. https://doi.org/10.1037/a0014802
United States Department of Labor. (2014). Occupational Noise Exposure - Overview Occupational Safety and Health Administration. https://www.osha.gov/SLTC/noisehearingconservation/index.html
Veterans Affairs Canada (2024). Ear Anatomy [Image]. License purchased for use from Human Ear Anatomy. Ear Structure Diagram. The Human Ear Consists Of The Outer, Middle And Inner Ear. Royalty Free SVG, Cliparts, Vectors, and Stock Illustration. Image 180301021. (123rf.com)
Völter, C., Götze, L., Dazert, S., Falkenstein, M., & Thomas, J. P. (2018). Can cochlear implantation improve neurocognition in the aging population? Clinical Interventions in Aging, 13, 701–712. https://doi.org/10.2147/CIA.S160517
Völter, C., Götze, L., Haubitz, I., Müther, J., Dazert, S., & Thomas, J. P. (2021). Impact of Cochlear Implantation on Neurocognitive Subdomains in Adult Cochlear Implant Recipients. Audiology & Neuro-Otology, 26(4), 236–245. https://doi.org/10.1159/000510855
Waddell, K., DeMario, P., Dass, R., Grewak, E., Alam, S., & Wilson, M. (2024). Rapid evidence profile #76: Examining the association between hearing loss and dementia. Hamilton: McMaster Health Forum. https://www.mcmasterforum.org/about-us/products
Waddell K, Wu N, Demaio P, Bain T, Bhuiya A, Wilson MG. Rapid evidence profile #71: Examining the association between noise exposure and hearing loss. Hamilton: McMaster Health Forum. 10 May 2024. Examining the association between noise exposure and delayed hearing loss (mcmasterforum.org)
Weber, P. (2023). Sudden sensorineural hearing loss in adults: Evaluation and Management. UpToDate, Inc.
World Health Organization. (2022). ICD-11: International classification of diseases (11th revision). https://icd.who.int/en
Yankaskas, K. (2013). Prelude: Noise-induced tinnitus and hearing loss in the military. Hearing Research, 295, 3–8. https://doi.org/10.1016/j.heares.2012.04.016
Yong, J., & Wang, D.-Y. (2015). Impact of noise on hearing in the military. Military Medical Research, 2(1), 6. https://doi.org/10.1186/s40779-015-0034-5
Zanon, A., Sorrentino, F., Franz, L., & Brotto, D. (2019). Gender-related hearing, balance and speech disorders: A review. Hearing, Balance and Communication, 17(3), 203–212. https://doi.org/10.1080/21695717.2019.1615812